REKLAMA
Dziennik Ustaw - rok 2003 nr 65 poz. 608
ROZPORZĄDZENIE MINISTRA SPRAWIEDLIWOŚCI
z dnia 26 lutego 2003 r.
w sprawie wydawania produktów leczniczych i wyrobów medycznych z aptek zakładowych w zakładach opieki zdrowotnej dla osób pozbawionych wolności
Na podstawie art. 96 ust. 7 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz. U. Nr 126, poz. 1381, z późn. zm.1)) zarządza się, co następuje:
1) obowiązki osób realizujących zapotrzebowanie na zakup produktów leczniczych lub wyrobów medycznych, sporządzających lek recepturowy lub apteczny;
2) przypadki, kiedy można odmówić wydania produktu leczniczego lub wyrobu medycznego;
3) dane, jakie powinno zawierać zapotrzebowanie na zakup produktów leczniczych lub wyrobów medycznych;
4) sposób i tryb ewidencjonowania recept farmaceutycznych.
2. Osoba realizująca zapotrzebowanie na produkty lecznicze lub wyroby medyczne obowiązana jest do:
1) sprawdzenia prawidłowości wystawienia zapotrzebowania;
2) umieszczenia na zapotrzebowaniu:
a) pieczęci apteki zakładowej,
b) daty przyjęcia zapotrzebowania do realizacji,
c) daty realizacji zapotrzebowania,
d) swojego podpisu i pieczątki;
3) sprawdzenia terminu ważności wydawanych produktów leczniczych lub wyrobów medycznych, o ile to ich dotyczy;
4) kontroli wizualnej, jeżeli jest to możliwe, czy produkt leczniczy nie wykazuje cech świadczących o jego niewłaściwej jakości, a w przypadku wyrobu medycznego, czy jest on zgodny z wymaganiami zasadniczymi, szczególnie w zakresie opakowania i oznakowania tych wyrobów;
5) udzielenia, w razie potrzeby, osobie odbierającej produkt leczniczy lub wyrób medyczny informacji co do sposobu jego stosowania i przechowywania oraz innych dotyczących działania farmakologicznego i ewentualnych interakcji, w które może on wchodzić;
6) sprawdzenia, czy osoba, która zgłosiła się po odbiór produktów leczniczych lub wyrobów medycznych, została do tej czynności upoważniona w zapotrzebowaniu;
7) zażądania na zapotrzebowaniu podpisu i ewentualnie pieczątki osoby odbierającej z apteki zakładowej produkty lecznicze lub wyroby medyczne.
3. Osoba realizująca zapotrzebowanie może:
1) wydać produkt leczniczy w dawce mniejszej niż określona w zapotrzebowaniu, jeżeli dawka ta stanowi wielokrotność dawki, w której produkt leczniczy jest wydawany; ilość substancji czynnej, zawartej w produkcie leczniczym wydawanym w dawce mniejszej, ma łącznie odpowiadać ilości substancji czynnej zawartej w produkcie leczniczym w dawce określonej w zapotrzebowaniu;
2) wprowadzić korektę postaci farmaceutycznej produktu leczniczego;
3) wydać produkt leczniczy będący odpowiednikiem oryginalnego gotowego produktu leczniczego.
4. Osoba realizująca zapotrzebowanie:
1) odnotowuje w zapotrzebowaniu zmiany, o których mowa w ust. 3, umieszczając obok stosownej adnotacji swój podpis i pieczątkę;
2) informuje o zmianach osobę, której produkt leczniczy jest wydawany.
1) stosuje, z zastrzeżeniem pkt 2, surowce farmaceutyczne niezbędne do przygotowania danej postaci leku recepturowego;
2) stosuje surowiec o najniższym stężeniu, jeżeli w zapotrzebowaniu – jako wchodzący w skład leku recepturowego – wymieniony został surowiec farmaceutyczny występujący w kilku stężeniach, a stężenie tego surowca nie zostało określone;
3) dokonuje korekty składu leku recepturowego, jeżeli podany w zapotrzebowaniu skład może tworzyć niezgodność chemiczną lub fizyczną, mogącą zmienić działanie leku lub jego wygląd, przez:
a) dodanie surowca farmaceutycznego ułatwiającego prawidłowe przygotowanie postaci leku recepturowego lub pozwalającego na uzyskanie jednolitego dawkowania,
b) prawidłowy dobór surowców farmaceutycznych, zapewniający rozpuszczenie wszystkich składników leku recepturowego w celu uzyskania jednolitej postaci,
c) zmianę postaci surowca farmaceutycznego z rozpuszczalnej na nierozpuszczalną lub odwrotnie, z uwzględnieniem koniecznej różnicy w ilości surowca;
4) zmniejsza ilość surowca farmaceutycznego w składzie leku recepturowego do wielkości określonej przez dawkę maksymalną, jeżeli:
a) dawka maksymalna jest dla tego surowca ustalona,
b) ze składu oraz sposobu użycia podanego w zapotrzebowaniu wynika, że nastąpiło przekroczenie dawki maksymalnej, a wystawiający zapotrzebowanie nie uczynił adnotacji o konieczności zastosowania dawki wskazanej w składzie leku;
5) umieszcza na zapotrzebowaniu adnotacje o dacie i czasie sporządzenia leku recepturowego oraz składa swój podpis i pieczątkę.
2. Surowce farmaceutyczne i postać leku recepturowego. o których mowa w ust. 1 pkt 1, muszą spełniać wymagania określone w Farmakopei Polskiej lub Farmakopei Europejskiej lub innych odpowiednich farmakopeach uznawanych w państwach członkowskich Unii Europejskiej.
3. Osoba sporządzająca lek recepturowy może dokonać zmian innych niż wymienione w ust. 1 pkt 3 i 4 jedynie po porozumieniu się z osobą, która wystawiła zapotrzebowanie.
4. Osoba sporządzająca lek recepturowy odnotowuje na zapotrzebowaniu dokonane zmiany oraz umieszcza swój podpis i pieczątkę.
5. Przepisy ust. 1 i 2 stosuje się odpowiednio w przypadku osoby sporządzającej lek apteczny.
1) pieczęć zakładu opieki zdrowotnej dla osób pozbawionych wolności lub oddziału szpitalnego takiego zakładu;
2) datę wystawienia;
3) nazwę produktu leczniczego lub wyrobu medycznego;
4) postać farmaceutyczną, dawkę, wielkość opakowania;
5) ilość;
a) wymaganą celem uzupełnienia w ambulatorium zakładu opieki zdrowotnej dla osób pozbawionych wolności lub oddziale szpitalnym takiego zakładu
b) posiadaną aktualnie w chwili wystawiania zapotrzebowania dla każdego produktu leczniczego lub wyrobu medycznego wymagającego uzupełnienia,
c) stanowiącą normatyw bieżącego zapasu dla każdego produktu leczniczego lub wyrobu medycznego wymagającego uzupełnienia, albo
d) przepisaną pacjentowi w przypadku wystawienia zapotrzebowania, o którym mowa w ust. 2;
6) pieczątkę i podpis lekarza pełniącego służbę lub zatrudnionego w zakładzie opieki zdrowotnej dla osób pozbawionych wolności, uprawnionego do wystawiania zapotrzebowania.
2. Zapotrzebowanie lekarskie imienne, poza danymi wymienionymi w ust. 1 pkt 1–4 i pkt 5 lit. d, powinno zawierać:
1) imię i nazwisko oraz imię ojca pacjenta;
2) sposób dawkowania.
3. Ilość, normatywy bieżących zapasów oraz aktualne stany uzupełnianych produktów leczniczych lub wyrobów medycznych powinny być określone dla form takich, jak w szczególności: tabletki, ampułki, czopki – w sztukach, a dla form takich, jak w szczególności: maści, syropy, krople – w opakowaniach.
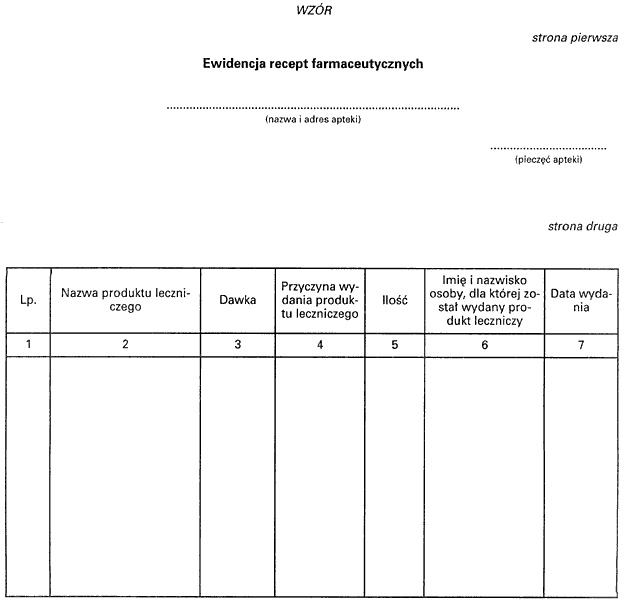
2. Wzór ewidencji, o której mowa w ust. 1, stanowi załącznik do rozporządzenia,
3. Dopuszcza się prowadzenie ewidencji, o której mowa w ust. 1, w formie elektronicznej, zabezpieczonej przed dostępem osób nieuprawnionych.
1) zachodzi uzasadnione podejrzenie co do autentyczności zapotrzebowania;
2) konieczne jest dokonanie zmian, o których mowa w § 3 ust. 3, oraz określonych w odrębnych przepisach, przy braku możliwości porozumienia się z osobą, która wystawiła zapotrzebowanie;
3) zapotrzebowanie nie spełnia wymogów określonych w § 4.
Minister Sprawiedliwości: G. Kurczuk
|
|
1) Zmiany wymienionej ustawy zostały ogłoszone w Dz. U. z 2002 r. Nr 113, poz. 984, Nr 141, poz. 1181 i Nr 152, poz. 1265 oraz z 2003 i. Nr 45, poz. 391.
2) Niniejsze rozporządzenie było poprzedzone rozporządzeniem Ministra Sprawiedliwości z dnia 23 kwietnia 1993 r. w sprawie typów aptek w zakładach karnych, określenia wymogów lokalowych i wyposażenia tych aptek, zasad wydawania leków i materiałów medycznych oraz obrotu detalicznego środkami farmaceutycznymi i materiałami medycznymi poza aptekami (Dz. U. Nr 38, poz. 167), które utraciło moc z dniem 2 stycznia 2003 r. na podstawie art. 27 ustawy z dnia 6 września 2001 r. – Przepisy wprowadzające ustawę – Prawo farmaceutyczne, ustawę o wyrobach medycznych oraz ustawę o Urzędzie Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (Dz. U. Nr 126, poz. 1382 i Nr 154, poz. 1801 oraz z 2002 r. Nr 32, poz. 300 i Nr 152, poz. 1266).
Załącznik do rozporządzenia Ministra Sprawiedliwości
z dnia 26 lutego 2003 r. (poz. 608)
- Data ogłoszenia: 2003-04-16
- Data wejścia w życie: 2003-05-01
- Data obowiązywania: 2003-05-01
- Dokument traci ważność: 2016-12-20
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA

