REKLAMA
Dziennik Ustaw - rok 2004 nr 180 poz. 1870
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 4 sierpnia 2004 r.
w sprawie sposobu ustalania i uiszczania opłat związanych z dopuszczeniem do obrotu produktu leczniczego
Na podstawie art. 36a ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz. U. z 2004 r. Nr 53, poz. 533, z późn. zm.2)) zarządza się, co następuje:
2. Opłaty ustalone, zgodnie z ust. 1, zaokrągla się do pełnego złotego w ten sposób, że kwoty wynoszące mniej niż 50 groszy pomija się, a 50 i więcej groszy podwyższa się do pełnych złotych.
2. W przypadku gdy podmiot odpowiedzialny za wprowadzenie produktu leczniczego na rynek składa więcej niż jeden wniosek o wydanie pozwolenia lub jego zmianę w odniesieniu do produktów leczniczych różniących się dawką, opłata za złożenie kolejnego wniosku o dopuszczenie do obrotu produktu leczniczego wynosi 30 % opłaty za złożenie wniosku.
1) aktualizację raportu oceniającego, o którym mowa w art. 19 ust. 5 ustawy – w wysokości 50 % opłaty za wydanie pozwolenia na dopuszczenie do obrotu produktu leczniczego zgodnie z tabelą określoną w załączniku nr 1 do rozporządzenia;
2) złożenie wniosku, o którym mowa w art. 19 ust. 1 ustawy:
a) dla produktu leczniczego oryginalnego – w wysokości 5000 % kwoty bazowej,
b) dla odpowiedników oryginalnego produktu leczniczego – w wysokości 1625 % kwoty bazowej;
3) przygotowanie dokumentów stanowiących podstawę wszczęcia procedury wyjaśniającej – w wysokości 30 % opłaty za wydanie pozwolenia zgodnie z tabelą określoną w załączniku nr 1 do rozporządzenia.
2. W przypadku gdy podmiot odpowiedzialny za wprowadzenie produktu leczniczego na rynek składa więcej niż jeden wniosek, o którym mowa w ust. 1 pkt 2, w odniesieniu do produktów leczniczych różniących się postacią, opłata za złożenie kolejnego wniosku o dopuszczenie do obrotu produktu leczniczego wynosi 70 % opłaty za złożenie wniosku.
3. W przypadku gdy podmiot odpowiedzialny za wprowadzenie produktu leczniczego na rynek składa więcej niż jeden wniosek, o którym mowa w ust. 1 pkt 2, w odniesieniu do produktów leczniczych różniących się dawką, opłata za złożenie kolejnego wniosku o dopuszczenie do obrotu produktu leczniczego wynosi 30 % opłaty za złożenie wniosku.
2. Opłaty należne z różnych tytułów uiszcza się oddzielnie.
3. Potwierdzenie uiszczenia opłaty składa się wraz z wnioskiem o dokonanie czynności związanej z dopuszczeniem do obrotu produktu leczniczego lub dokonaniem zmian w pozwoleniu i dokumentacji dotyczącej wprowadzenia do obrotu produktu leczniczego lub z wnioskiem o przedłużenie terminu ważności pozwolenia na dopuszczenie do obrotu.
Minister Zdrowia: M. Balicki
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 11 czerwca 2004 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 134, poz. 1439).
2) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2004 r. Nr 69, poz. 625, Nr 91, poz. 877, Nr 92, poz. 882, Nr 93, poz. 896 i Nr 173, poz. 1808.
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 4 sierpnia 2004 r. (poz. 1870)
Załącznik nr 1
SZCZEGÓŁOWY SPOSÓB USTALANIA OPŁAT ZWIĄZANYCH Z DOPUSZCZENIEM DO OBROTU PRODUKTU LECZNICZEGO, O KTÓRYCH MOWA W ART. 36 USTAWY Z DNIA 6 WRZEŚNIA 2001 R. – PRAWO FARMACEUTYCZNE
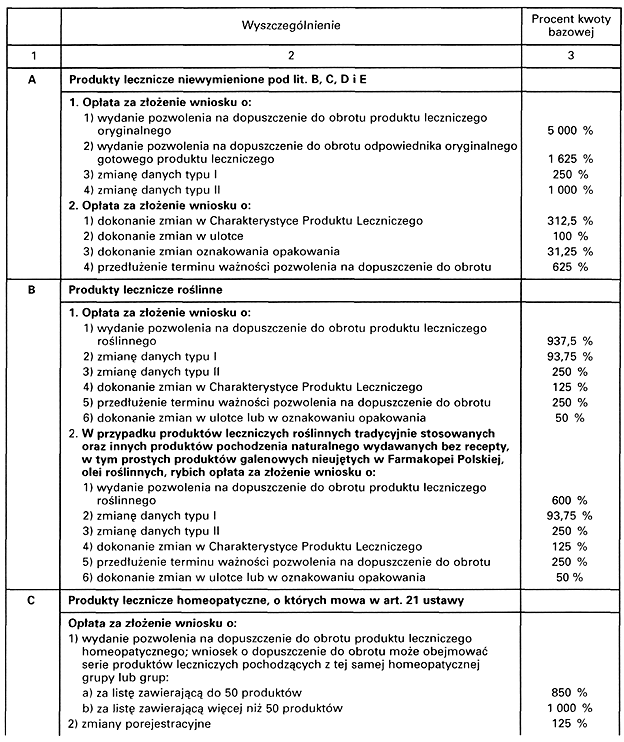
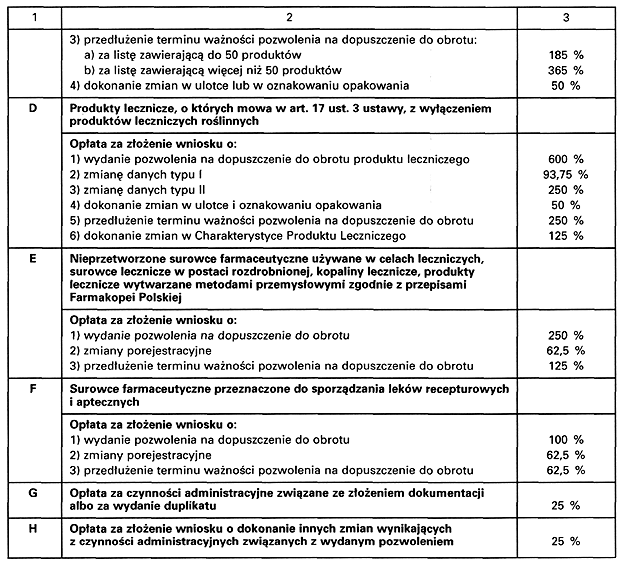
Załącznik nr 2
SZCZEGÓŁOWY SPOSÓB USTALANIA OPŁAT ZWIĄZANYCH Z DOPUSZCZENIEM DO OBROTU PRODUKTU LECZNICZEGO, O KTÓRYCH MOWA W ART. 21a UST. 9 USTAWY Z DNIA 6 WRZEŚNIA 2001 R. – PRAWO FARMACEUTYCZNE

- Data ogłoszenia: 2004-08-18
- Data wejścia w życie: 2004-09-02
- Data obowiązywania: 2005-06-29
- Dokument traci ważność: 2008-11-02
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA

