REKLAMA
Dziennik Ustaw - rok 2011 nr 20 poz. 109
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 12 stycznia 2011 r.
w sprawie wzoru wniosku o wydanie zezwolenia na wytwarzanie produktów leczniczych i badanych produktów leczniczych oraz wzoru wniosku o wydanie zezwolenia na import produktów leczniczych i badanych produktów leczniczych
Na podstawie art. 39 ust. 4 pkt 3 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz. U. z 2008 r. Nr 45, poz. 271, z późn. zm.2)) zarządza się, co następuje:
2. Do wniosku, o którym mowa w ust. 1, dołącza się następujące dokumenty:
1) informację o zakresie wytwarzania i rodzajach wytwarzanych produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 2 do rozporządzenia, lub informację o zakresie wytwarzania i rodzajach wytwarzanych badanych produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 3 do rozporządzenia; w przypadku występowania kilku miejsc wytwarzania załącznik nr 2 lub załącznik nr 3 do rozporządzenia należy wypełnić odrębnie dla każdego z tych miejsc;
2) listę produktów leczniczych wytwarzanych w miejscu wytwarzania, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 4 do rozporządzenia, lub listę badanych produktów leczniczych wytwarzanych w miejscu wytwarzania, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 5 do rozporządzenia; w przypadku występowania kilku miejsc wytwarzania załącznik nr 4 lub załącznik nr 5 do rozporządzenia należy wypełnić odrębnie dla każdego z tych miejsc;
3) kopię pozwolenia na dopuszczenie do obrotu produktu leczniczego, jeżeli dotyczy, a w przypadku produktów leczniczych nieposiadających pozwolenia na dopuszczenie do obrotu kopię pierwszej strony wniosku o wydanie pozwolenia na dopuszczenie do obrotu z potwierdzeniem wpływu, jeżeli dotyczy;
4) informację zawierającą dane osób wykwalifikowanych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 6 do rozporządzenia;
5) Dokumentację Główną Wytwórni, zawierającą szczegółowe dane o zapewnieniu jakości, w tym spełnieniu wymagań Dobrej Praktyki Wytwarzania, oraz o pomieszczeniach, urządzeniach technicznych i kontrolnych niezbędnych do wytwarzania, kontroli i przechowywania produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 7 do rozporządzenia, zgodną ze stanem faktycznym na dzień złożenia wniosku;
6) kopię zaświadczenia o nadanym numerze identyfikacyjnym w krajowym rejestrze urzędowym podmiotów gospodarki narodowej (REGON);
7) odpis z Krajowego Rejestru Sądowego, jeżeli dotyczy.
2. Do wniosku, o którym mowa w ust. 1, dołącza się następujące dokumenty:
1) informację o zakresie importu i rodzajach importowanych produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 9 do rozporządzenia, lub informację o zakresie importu i rodzajach importowanych badanych produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 10 do rozporządzenia; w przypadku występowania kilku miejsc prowadzenia działalności w zakresie importu załącznik nr 9 lub załącznik nr 10 do rozporządzenia należy wypełnić odrębnie dla każdego z tych miejsc;
2) listę importowanych produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 11 do rozporządzenia, lub listę badanych importowanych produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 12 do rozporządzenia; w przypadku występowania kilku miejsc prowadzenia działalności w zakresie importu załącznik nr 11 lub załącznik nr 12 do rozporządzenia należy wypełnić odrębnie dla każdego z tych miejsc;
3) kopię pozwolenia na dopuszczenie do obrotu produktu leczniczego, jeżeli dotyczy, a w przypadku produktów leczniczych nieposiadających pozwolenia na dopuszczenie do obrotu kopię pierwszej strony wniosku o wydanie pozwolenia na dopuszczenie do obrotu z potwierdzeniem wpływu, jeżeli dotyczy;
4) informację zawierającą dane osób wykwalifikowanych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 6 do rozporządzenia;
5) Dokumentację Główną Importera, zawierającą szczegółowe dane o zapewnieniu jakości, w tym spełnieniu wymagań Dobrej Praktyki Wytwarzania, oraz o pomieszczeniach, urządzeniach technicznych i kontrolnych niezbędnych do wytwarzania, kontroli i przechowywania produktów leczniczych, sporządzoną zgodnie z wzorem stanowiącym załącznik nr 13 do rozporządzenia, zgodną ze stanem faktycznym na dzień złożenia wniosku;
6) kopię zaświadczenia o nadanym numerze identyfikacyjnym w krajowym rejestrze urzędowym podmiotów gospodarki narodowej (REGON);
7) odpis z Krajowego Rejestru Sądowego, jeżeli dotyczy.
Minister Zdrowia: E. Kopacz
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 16 listopada 2007 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 216, poz. 1607).
2) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2008 r. Nr 227, poz. 1505 i Nr 234, poz. 1570, z 2009 r. Nr 18, poz. 97, Nr 31, poz. 206, Nr 92, poz. 753, Nr 95, poz. 788 i Nr 98, poz. 817 oraz z 2010 r. Nr 78, poz. 513 i Nr 107, poz. 679.
3) Niniejsze rozporządzenie było poprzedzone rozporządzeniem Ministra Zdrowia z dnia 5 sierpnia 2008 r. w sprawie wzoru wniosku o wydanie zezwolenia na wytwarzanie produktów leczniczych i wzoru wniosku o wydanie zezwolenia na import produktów leczniczych (Dz. U. Nr 151, poz. 948).
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 12 stycznia 2011 r. (poz. 109)
Załącznik nr 1
WZÓR - WNIOSEK O WYDANIE ZEZWOLENIA NA WYTWARZANIE PRODUKTÓW LECZNICZYCH/BADANYCH PRODUKTÓW LECZNICZYCH

Załącznik nr 2
WZÓR - INFORMACJA O ZAKRESIE WYTWARZANIA I RODZAJACH WYTWARZANYCH PRODUKTÓW LECZNICZYCH



Załącznik nr 3
WZÓR - INFORMACJA O ZAKRESIE WYTWARZANIA I RODZAJACH WYTWARZANYCH BADANYCH PRODUKTÓW LECZNICZYCH



Załącznik nr 4
WZÓR - LISTA PRODUKTÓW LECZNICZYCH WYTWARZANYCH W MIEJSCU WYTWARZANIA

Załącznik nr 5
WZÓR - LISTA BADANYCH PRODUKTÓW LECZNICZYCH WYTWARZANYCH W MIEJSCU WYTWARZANIA

Załącznik nr 6
WZÓR - INFORMACJA ZAWIERAJĄCA DANE OSÓB WYKWALIFIKOWANYCH

Załącznik nr 7
WZÓR - DOKUMENTACJA GŁÓWNA WYTWÓRNI




Załącznik nr 8
WZÓR – WNIOSEK O WYDANIE ZEZWOLENIA NA IMPORT PRODUKTÓW LECZNICZYCH/BADANYCH PRODUKTÓW LECZNICZYCH

Załącznik nr 9
WZÓR – INFORMACJA O ZAKRESIE IMPORTU I RODZAJACH IMPORTOWANYCH PRODUKTÓW LECZNICZYCH

Załącznik nr 10
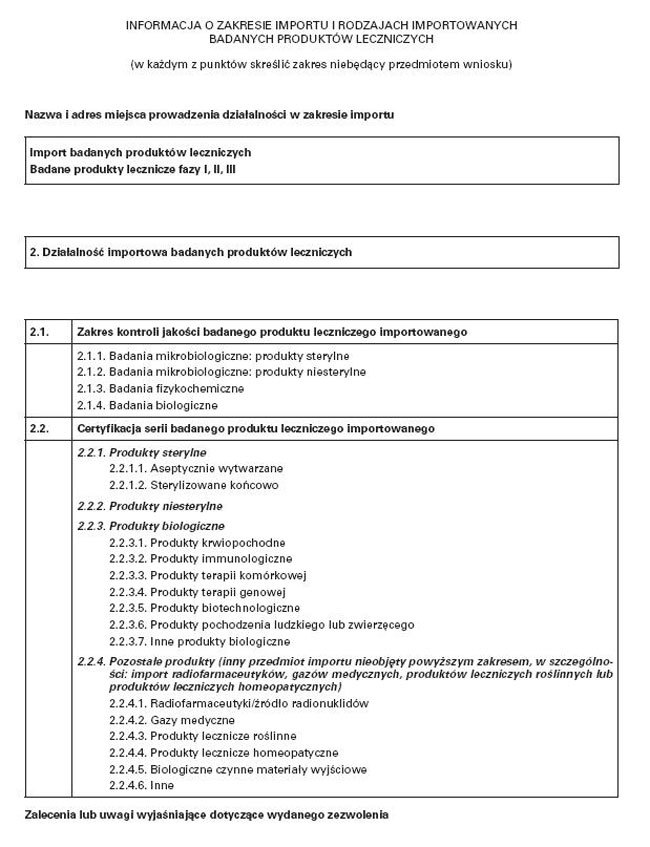
WZÓR – INFORMACJA O ZAKRESIE IMPORTU I RODZAJACH IMPORTOWANYCH BADANYCH PRODUKTÓW LECZNICZYCH
Załącznik nr 11
WZÓR – LISTA IMPORTOWANYCH PRODUKTÓW LECZNICZYCH

Załącznik nr 12
WZÓR – LISTA BADANYCH IMPORTOWANYCH PRODUKTÓW LECZNICZYCH

Załącznik nr 13
WZÓR – DOKUMENTACJA GŁÓWNA IMPORTERA



- Data ogłoszenia: 2011-01-28
- Data wejścia w życie: 2011-02-12
- Data obowiązywania: 2012-04-20
- Dokument traci ważność: 2013-08-12
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA

