REKLAMA
Dziennik Ustaw - rok 2003 nr 147 poz. 1439
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 4 sierpnia 2003 r.
w sprawie nadzoru nad warunkami wytwarzania w wytwórniach wytwarzających produkty lecznicze weterynaryjne
Na podstawie art. 108 ust. 5 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz. U. Nr 126, poz. 1381, z późn. zm.2)) zarządza się, co następuje:
1) Głównego Inspektora Farmaceutycznego – inspektorom farmaceutycznym do spraw wytwarzania,
2) wojewódzkiego lekarza weterynarii na wniosek Głównego Lekarza Weterynarii – weterynaryjnym inspektorom farmaceutycznym
– zwanym dalej „inspektorami”.
2. Wzór upoważnienia, o którym mowa w ust. 1 pkt 1, określa załącznik nr 1 do rozporządzenia.
3. Wzór upoważnienia, o którym mowa w ust. 1 pkt 2, określa załącznik nr 2 do rozporządzenia.
4. Upoważnienia, o których mowa w ust. 1, wydaje się w trzech jednobrzmiących egzemplarzach.
5. W upoważnieniach, o których mowa w ust. 1, określa się termin i zakres kontroli.
6. Zakres przeprowadzanej kontroli obejmuje sprawdzenie, czy przedsiębiorca wytwarzający produkty lecznicze weterynaryjne spełnia wymagania określone w rozporządzeniu Ministra Zdrowia z dnia 3 grudnia 2002 r. w sprawie wymagań Dobrej Praktyki Wytwarzania (Dz. U. Nr 224, poz. 1882).
2. Rozpoczęcie kontroli potwierdzają inspektorzy, dokonując odpowiedniego wpisu w książce kontroli, ze wskazaniem zakresu kontroli.
3. Inspektor farmaceutyczny do spraw wytwarzania, dokonując kontroli okresowej wytwórni produktów leczniczych weterynaryjnych, podaje kontrolowanemu przed rozpoczęciem kontroli plan przebiegu kontroli, w tym przewidywany okres prowadzenia kontroli, zakres kontroli oraz wykaz personelu zobowiązanego do składania wyjaśnień, istotnych dla czynności kontrolnych, w celu prawidłowego i sprawnego przeprowadzenia kontroli.
2. Oświadczenie o rezygnacji z prawa uczestniczenia w czynnościach kontrolnych składane jest na piśmie. W razie odmowy złożenia oświadczenia inspektorzy dokonują odpowiedniej adnotacji w raporcie kontroli.
3. W przypadku nieobecności kontrolowanego lub osoby wymienionej w ust. 1, czynności kontrolnych dokonuje się w obecności przywołanego świadka. Świadek nie musi być obecny przy czynnościach kontrolnych dotyczących przeprowadzenia dowodu z ksiąg, ewidencji, zapisków lub innych dokumentów.
2. W kontroli mogą brać udział biegli i specjaliści na podstawie imiennego upoważnienia wydanego przez Głównego Inspektora Farmaceutycznego lub Głównego Lekarza Weterynarii.
2. Raport, o którym mowa w ust. 1, zawiera:
1) wskazanie kontrolowanego;
2) imiona i nazwiska inspektorów;
3) określenie przedmiotu i zakresu kontroli;
4) określenie miejsca i czasu kontroli;
5) opis dokonanych ustaleń;
6) przedstawienie dowodów;
7) pouczenie o prawie złożenia zastrzeżeń lub wyjaśnień.
3. Raport, z zastrzeżeniem § 8 ust. 2, podpisują:
1) kontrolowany lub osoba upoważniona;
2) inspektorzy;
3) osoby, których wyjaśnienia jako istotne dla czynności kontrolnych przytoczone zostały w raporcie.
4. Do raportu dołącza się oryginały upoważnień, o których mowa w § 3 ust. 1.
2. Kontrolowany, który nie zgadza się z ustaleniami raportu, może w terminie 3 dni od dnia jego doręczenia złożyć zastrzeżenia lub wyjaśnienia, wskazując jednocześnie stosowne wnioski dowodowe; inspektorzy obowiązani są rozpatrzyć zgłoszone zastrzeżenia i uzupełnić raport oraz przedstawić go ponownie do podpisu osobie, o której mowa w § 7 ust. 3 pkt 1, w terminie 7 dni.
3. W przypadku odmowy podpisania raportu odmawiający składa pisemne wyjaśnienie co do przyczyn odmowy.
4. O odmowie podpisania raportu, przyczynie tej odmowy oraz o złożeniu wyjaśnień inspektorzy dokonują wzmianki w raporcie.
5. Po zakończeniu kontroli inspektor farmaceutyczny do spraw wytwarzania dokonuje wpisu w książce kontroli, o której mowa w § 14.
2. W przypadkach zagrożenia życia lub zdrowia ludzi lub zwierząt, wymagających niezwłocznego pobrania prób do badań, dopuszcza się wykonanie tej czynności przez jednego inspektora.
3. Próbki do badań pobiera się w ilości niezbędnej do przeprowadzenia właściwego badania laboratoryjnego.
4. Protokół pobrania próbki sporządza się w czterech egzemplarzach, z których jeden pozostawia się kontrolowanemu, drugi dołącza się do próbki kierowanej do badań jakościowych, trzeci i czwarty pozostawia się w dokumentacji inspektorów.
2. Do próbki do badań należy dołączyć protokół, o którym mowa w § 9, oraz sporządzony przez inspektora farmaceutycznego do spraw wytwarzania, z zastrzeżeniem § 9 ust. 2, wniosek o przeprowadzenie badań laboratoryjnych.
2. Wykonujący badania jeden egzemplarz orzeczenia, o którym mowa w ust. 1, pozostawia u siebie, drugi egzemplarz przekazuje kontrolowanemu, a dwa pozostałe egzemplarze przekazuje wnioskodawcy.
2. Książkę kontroli należy okazywać na każde żądanie inspektorów.
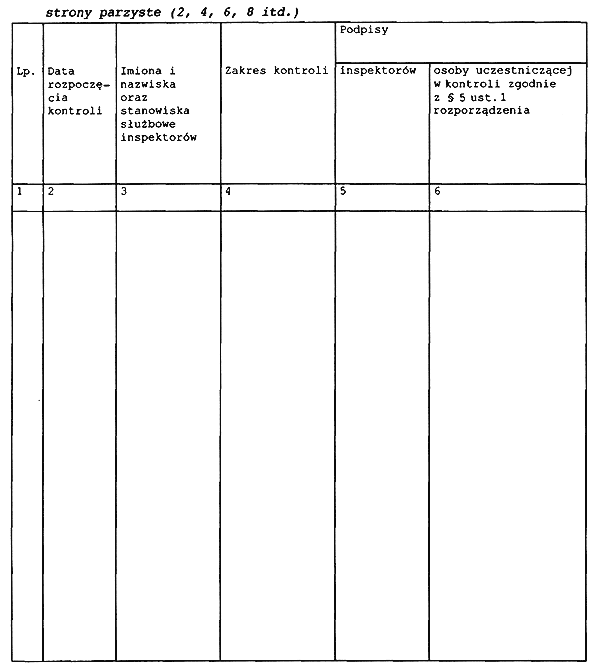
3. Wzór książki kontroli stanowi załącznik nr 5 do rozporządzenia.
2. Inspektor może dokonywać skreśleń i poprawek we wpisie w taki sposób, aby wyrazy skreślone i poprawione były czytelne; skreślenia i poprawki należy opatrzyć podpisem osoby ich dokonującej.
3. Skreślenia i poprawki powinny być dokonane przed podpisaniem wpisu.
Minister Zdrowia: L. Sikorski
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 28 czerwca 2002 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 93, poz. 833).
2) Zmiany wymienionej ustawy zostały ogłoszone w Dz. U. z 2002 r. Nr 113, poz. 984, Nr 141, poz. 1181 i Nr 152, poz. 1265 oraz z 2003 r. Nr 45, poz. 391.
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 4 sierpnia 2003 r. (poz. 1439)
Załącznik nr 1

Załącznik nr 2

Załącznik nr 3

Załącznik nr 4


Załącznik nr 5


- Data ogłoszenia: 2003-08-26
- Data wejścia w życie: 2003-09-10
- Data obowiązywania: 2003-09-10
- Dokument traci ważność: 2007-05-01
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA

