REKLAMA
Dziennik Ustaw - rok 2000 nr 77 poz. 885
ROZPORZĄDZENIE MINISTRA ZDROWIA
z dnia 3 sierpnia 2000 r.
w sprawie wytwarzania, przetwarzania, przerobu, przywozu z zagranicy lub wywozu za granicę oraz obrotu środkami odurzającymi, substancjami psychotropowymi i prekursorami.
Na podstawie art. 23 ust. 14, art. 25 ust. 4, art. 27 ust. 6, art. 28 ust. 4, art. 29 ust. 2 i art. 30 ust. 2 ustawy z dnia 24 kwietnia 1997 r. o przeciwdziałaniu narkomanii (Dz. U. Nr 75, poz. 468, z 1998 r. Nr 106, poz. 668 i Nr 113, poz. 715 oraz z 2000 r. Nr 20, poz. 256) zarządza się, co następuje:
1) szczegółowe warunki i tryb wydawania oraz cofania zezwoleń na wytwarzanie, przetwarzanie, przerabianie, a także stosowanie w celach przemysłowych albo w celu prowadzenia badań naukowych środków odurzających, substancji psychotropowych lub prekursorów w zakresie określonym w art. 23 ust. 1–3, 6 i 8 ustawy z dnia 24 kwietnia 1997 r. o przeciwdziałaniu narkomanii, zwanej dalej „ustawą", przez podmioty gospodarcze, szkoły wyższe, jednostki badawczo-rozwojowe, inne placówki naukowe oraz inne jednostki organizacyjne, a także obowiązki podmiotów posiadających te zezwolenia,
2) szczegółowe warunki zgłaszania działalności polegającej na prowadzeniu badań naukowych przy zastosowaniu środków odurzających grup I-N i II-N, substancji psychotropowych grupy II-P lub prekursorów grupy I-R oraz polegającej na wytwarzaniu, przetwarzaniu, przerobie lub stosowaniu prekursorów z grupy I-R, na której prowadzenie nie jest, zgodnie z ustawą, wymagane zezwolenie, oraz obowiązki podmiotów zobowiązanych do zgłaszania takiej działalności,
3) szczegółowe warunki i tryb wydawania zezwoleń na przywóz lub wywóz za granicę środków odurzających lub substancji psychotropowych oraz prekursorów grupy I-R i słomy makowej, a także obowiązki podmiotów posiadających te zezwolenia,
4) szczegółowe warunki i tryb wydawania oraz cofania zezwoleń na obrót hurtowy środkami odurzającymi lub substancjami psychotropowymi oraz prekursorami grupy I-R, obowiązki podmiotów prowadzących tę działalność, a także szczegółowe warunki zgłaszania działalności polegającej na obrocie hurtowym prekursorami grupy I-R oraz obowiązki podmiotów gospodarczych zobowiązanych do zgłoszenia tej działalności,
5) szczegółowe warunki przechowywania przez apteki środków odurzających, substancji psychotropowych i preparatów zawierających te środki lub substancje oraz sposób prowadzenia dokumentacji w zakresie ich posiadania i obrotu, określenie preparatów zawierających środki odurzające grupy II-N oraz substancje psychotropowe grup III-P i IV-P, których wydawanie przez aptekę może być dokonane na podstawie recepty nie wymagającej specjalnego oznakowania, oraz preparatów zawierających środki odurzające grupy III-N, które mogą być wydawane bez recepty, a także szczegółowe warunki wystawiania recept i zapotrzebowań na preparaty zawierające środki odurzające lub substancje psychotropowe oraz wydawania tych preparatów z aptek,
6) rodzaje preparatów zawierających środki odurzające grup I-N, II-N i III-N lub substancje psychotropowe grup II-P, III-P i IV-P, które zostały dopuszczone do obrotu jako środki farmaceutyczne, i ich ilości, jakie mogą posiadać w celach medycznych zakłady opieki zdrowotnej nie mające aptek zakładowych, zakłady lecznicze dla zwierząt oraz lekarz, lekarz stomatolog, lekarz weterynarii, prowadzący indywidualną praktykę lekarską oraz inny podmiot,
7) szczegółowe warunki i tryb składania sprawozdań przez podmioty gospodarcze i inne jednostki organizacyjne, które uzyskały zezwolenie na wytwarzanie, przetwarzanie lub przerabianie środków odurzających lub substancji psychotropowych, przywóz lub wywóz za granicę środków odurzających, substancji psychotropowych i prekursorów grupy I-R oraz słomy makowej, a także obrót hurtowy środkami odurzającymi lub substancjami psychotropowymi.
1) numer i datę wydania koncesji na wytwarzanie środków farmaceutycznych, w odniesieniu do podmiotów wytwarzających środki farmaceutyczne,
2) pełną nazwę i adres podmiotu wytwarzającego, przetwarzającego i przerabiającego,
3) wskazanie miejsca prowadzenia działalności określonej we wniosku,
4) określenie zakresu działalności, wyszczególnienie rodzaju środków odurzających, substancji psychotropowych i prekursorów grupy I-R,
5) techniczne uzasadnienie normy zużycia surowca wyjściowego oraz strat, jakie mogą powstać na poszczególnych etapach produkcji,
6) sposób przechowywania i zabezpieczania przed dostępem osób nieupoważnionych oraz systemu dystrybucji i dokumentacji,
7) dane osoby (imię, nazwisko, wykształcenie, staż pracy) odpowiedzialnej za zapewnienie systemu kontroli i zabezpieczania środków odurzających, substancji psychotropowych i prekursorów grupy I-R w wytwórni lub innej jednostce organizacyjnej,
8) datę sporządzenia wniosku oraz podpis osoby upoważnionej do reprezentowania podmiotu gospodarczego lub innej jednostki organizacyjnej.
1) nazwę szkoły wyższej i adres jednostki badawczo-rozwojowej lub innej placówki naukowej,
2) określenie jednostki organizacyjnej, w której będą wytwarzane, przerabiane, przetwarzane lub stosowane środki odurzające, substancje psychotropowe lub prekursory grupy I-R,
3) rodzaj, ilość i przeznaczenie każdego ze środków odurzających, substancji psychotropowych lub prekursorów grupy I-R,
4) sposób przechowywania i zabezpieczania środków odurzających, substancji psychotropowych i prekursorów grupy I-R przed ich kradzieżą bądź użyciem do celów niezgodnych z przeznaczeniem,
5) dane osoby (imię, nazwisko, wykształcenie, staż pracy) odpowiedzialnej za zapewnienie systemu kontroli i zabezpieczania tych środków i substancji w szkole wyższej, jednostce badawczo-rozwojowej lub innej placówce naukowej,
6) datę sporządzenia wniosku i podpis osoby upoważnionej do reprezentowania podmiotu gospodarczego lub innej jednostki organizacyjnej.
1) nazwę i adres podmiotu gospodarczego lub innej jednostki organizacyjnej,
2) wskazanie miejsca prowadzenia działalności określonej we wniosku,
3) rodzaj, ilość i przeznaczenie środków odurzających lub substancji psychotropowych oraz prekursorów grupy I-R,
4) dane osoby (imię, nazwisko, wykształcenie, staż pracy) odpowiedzialnej za zapewnienie systemu kontroli i zabezpieczania środków odurzających i substancji psychotropowych lub prekursorów grupy I-R,
5) sposób przechowywania i zabezpieczania środków odurzających, substancji psychotropowych i prekursorów grupy I-R przed ich kradzieżą bądź użyciem do celów niezgodnych z przeznaczeniem.
1) posiada procedury i system kontroli nad procesem wytwarzania, przetwarzania, przerobu, przechowywania i obrotu,
2) zatrudnia, z zastrzeżeniem ust. 2, pracownika będącego farmaceutą z co najmniej 2-letnim stażem pracy zawodowej, odpowiedzialnego za wytwarzanie, przetwarzanie lub przerób środka odurzającego, substancji psychotropowej i prekursorów grupy I-R, do którego obowiązków należy w szczególności:
a) prowadzenie ewidencji środków odurzających, substancji psychotropowych i prekursorów grupy l-R,
b) nadzorowanie przechowywania środków odurzających, substancji psychotropowych i prekursorów grupy I-R, w tym prób archiwalnych,
c) nadzorowanie przemieszczania środków odurzających, substancji psychotropowych i prekursorów grupy I-R wewnątrz zakładu oraz wprowadzanie ich do obrotu,
d) nadzorowanie zgodności zużycia środków odurzających, substancji psychotropowych i prekursorów grupy I-R do celów wytwarzania, przetwarzania lub przerobu z normami ustalonymi w sposób określony w pkt 5,
3) posiada system zabezpieczania pomieszczeń produkcyjnych i magazynowych środków odurzających, substancji psychotropowych i prekursorów grupy I-R przed kradzieżą bądź użyciem przez osoby nieupoważnione lub do celów niezgodnych z ich przeznaczeniem,
4) przedstawi sposób obrotu i ewidencji przychodu i rozchodu surowców używanych do produkcji półproduktów i produktu końcowego zgodny z rozporządzeniem,
5) ustali technicznie uzasadnione normy zużycia substancji wyjściowych uznanych za środki odurzające, substancje psychotropowe lub prekursory grupy I-R, użyte w procesie wytwarzania, oraz normy strat dopuszczalnych na poszczególnych etapach produkcji.
2. Podmioty gospodarcze nie prowadzące działalności gospodarczej w zakresie wytwarzania środków farmaceutycznych lub materiałów medycznych w rozumieniu ustawy z dnia 10 października 1991 r. o środkach farmaceutycznych, materiałach medycznych, aptekach, hurtowniach i Inspekcji Farmaceutycznej (Dz. U. Nr 105, poz. 452, z 1993 r. Nr 16, poz. 68 i Nr 47, poz. 211, z 1996 r. Nr 106, poz. 496, z 1997 r. Nr 28, poz. 152, Nr 43, poz. 272, Nr 60, poz. 369, Nr 88, poz. 554 i Nr 121, poz. 770, z 1998 r. Nr 106, poz. 668, z 1999 r. Nr 70, poz. 778 oraz z 2000 r. Nr 12, poz. 136 i Nr 50, poz. 599), a wykorzystujące prekursory grupy I-R, mogą zatrudnić na stanowisku, o którym mowa w ust. 1 pkt 2, osobę z wyższym wykształceniem chemicznym.
i III-P lub prekursorów grupy I-R, zezwolenie na stosowanie w celach przemysłowych środków odurzających grupy II-N, substancji psychotropowych grup II-P, III-P i IV-P lub prekursorów grupy I-R oraz zezwolenie na stosowanie w celu prowadzenia badań naukowych środków odurzających grupy IV-N lub substancji psychotropowych grup II-P, III-P i IV-P – wydaje się po stwierdzeniu, że warunki produkcji i obrotu zabezpieczają przed użyciem środków, substancji lub prekursorów objętych zezwoleniem przez osoby nieupoważnione lub w celach innych niż określone w wydanym zezwoleniu, a w szczególności, że podmiot:
1) posiada procedury i system kontroli nad procesem wytwarzania, przetwarzania, przerobu, przechowywania, obrotu i stosowania,
2) zatrudnia pracownika odpowiedzialnego za wytwarzanie, przetwarzanie, przerób i stosowanie środka odurzającego, substancji psychotropowej lub prekursora grupy I-R, wykonującego obowiązki określone w § 7 ust. 1 pkt 2, którym w odniesieniu do szkoły wyższej, jednostki badawczo-rozwojowej lub innej placówki naukowej jest pracownik naukowy lub pracownik badawczo-techniczny,
3) posiada system zabezpieczania pomieszczeń produkcyjnych i magazynowych.
1) prowadzenie ewidencji przychodu i rozchodu środków odurzających grup I-N i II-N, substancji psychotropowych grup II-P, III-P i IV-P oraz prekursorów grupy I-R,
2) prowadzenie, z zastrzeżeniem ust. 2, dokumentacji technicznie uzasadnionych norm zużycia środków odurzających, substancji psychotropowych i prekursorów grupy I-R oraz norm strat dopuszczonych na poszczególnych etapach produkcji,
3) wydawanie środków odurzających, substancji psychotropowych i prekursorów grupy I-R jedynie na podstawie pisemnego zapotrzebowania, którego wzór stanowi załącznik nr 1 do rozporządzenia, i za pokwitowaniem odbioru,
4) przechowywanie środków odurzających, substancji psychotropowych i prekursorów grupy I-R w wydzielonych pomieszczeniach wyposażonych w instalację alarmową oraz w drzwi odpowiedniej konstrukcji, zamykane co najmniej na dwa zamki o skomplikowanym mechanizmie otwierania, oraz okna zabezpieczone kratami metalowymi.
2. Prowadzenie dokumentacji, o której mowa w ust. 1 pkt 2, nie dotyczy szkół wyższych, jednostek badawczo-rozwojowych lub innych placówek naukowych.
2. Dopuszcza się prowadzenie dodatkowo ewidencji przychodu i rozchodu środków odurzających i substancji psychotropowych, o których mowa w ust. 1, w formie zapisu elektronicznego zabezpieczonego przed wprowadzaniem zmian poprzez wydruk danych lub sporządzenie ich zabezpieczonych kopii na nośnikach elektronicznych.
3. Ewidencję przychodu i rozchodu substancji psychotropowych grup III-P i IV-P oraz prekursorów grupy I-R prowadzi się w formie zapisu elektronicznego zabezpieczonego przed wprowadzaniem zmian poprzez wydruk danych lub sporządzanie ich zabezpieczonych kopii na nośnikach elektronicznych, wykonywanych nie rzadziej niż co siedem dni, kolejno numerowanych i przechowywanych przez 5 lat.
4. Książka kontroli przed rozpoczęciem jej prowadzenia wymaga zatwierdzenia.
5. Zatwierdzenie dokonywane jest przez opatrzenie książki podpisem i pieczęcią wojewódzkiego inspektora farmaceutycznego.
2. Wpisów w książce kontroli, odrębnych dla każdego rodzaju, postaci i dawki środka odurzającego lub substancji psychotropowej, dokonuje się na oddzielnej stronie książki kontroli w dniu przychodu lub rozchodu środka lub substancji. Ilość środka odurzającego lub substancji psychotropowej należy podawać w sztukach, kilogramach lub gramach.
3. Książkę kontroli przechowywać należy przez 5 lat, licząc od końca roku kalendarzowego, w którym dokonano ostatniego wpisu.
2. Cofnięcie zezwolenia następuje po stwierdzeniu przez wojewódzkiego inspektora farmaceutycznego nieprzestrzegania przepisów ustawy oraz niedotrzymywania warunków określonych w zezwoleniu.
3. Cofnięcia zezwolenia dokonuje organ, który je wydał.
2. Zgłoszenie, o którym mowa w ust. 1, powinno być dokonane w terminie co najmniej 30 dni przed rozpoczęciem działalności.
3. Zgłoszenie powinno zawierać:
1) pełną nazwę i adres podmiotu,
2) wskazanie miejsca działalności,
3) określenie zakresu działalności z wyszczególnieniem wykorzystywanych środków odurzających, substancji psychotropowych lub prekursorów grupy I-R,
4) sposób przechowywania i zabezpieczania przed kradzieżą lub zniszczeniem środków odurzających, substancji psychotropowych lub prekursorów grupy I-R.
4. Podmiot prowadzący działalność, o której mowa w ust. 1, zgłasza zaprzestanie działalności w terminie nie krótszym niż 30 dni przed jej zakończeniem.
1) nazwę i adres podmiotu gospodarczego ubiegającego się o certyfikat przywozu, a także w razie potrzeby nazwę podmiotu gospodarczego, na którego rzecz przywóz jest dokonywany,
2) numer zezwolenia, o którym mowa w art. 23 ust. 1 lub art. 27 ust. 1 ustawy,
3) rodzaj i ilość środka odurzającego, substancji psychotropowej, prekursora grupy I-R lub słomy makowej, które mają być przywiezione; jeżeli wniosek dotyczy preparatów, należy podać ponadto dawkę lub procentową zawartość czystego środka odurzającego, substancji psychotropowej lub prekursora grupy I-R; jeżeli dotyczy opium, należy podać ponadto jego gatunek i zawartość morfiny,
4) nazwę i adres wysyłającego oraz kraju wywozu,
5) wskazanie przejścia granicznego, przez które dokonany będzie przywóz,
6) wskazanie celu, w jakim dany środek odurzający, substancja psychotropowa, prekursor grupy I-R lub słoma makowa mają być przywiezione,
7) podpis pracownika odpowiedzialnego za wytwarzanie, przetwarzanie, przerób oraz przechowywanie i wprowadzanie do obrotu środków odurzających, substancji psychotropowych, prekursorów grupy I-R i słomy makowej.
2. Jeżeli wniosek, o którym mowa w ust. 1, składany jest w celu złożenia przesyłki w składzie celnym, podmiot gospodarczy powinien do wniosku dołączyć stosowne oświadczenie.
1) nazwę i adres podmiotu gospodarczego ubiegającego się o certyfikat wywozu, a także w razie potrzeby nazwę i adres podmiotu wytwarzającego,
2) numer zezwolenia na przywóz, wydany przez właściwe władze kraju przywozu,
3) rodzaj i ilość środka odurzającego, substancji psychotropowej, prekursora grupy I-R lub słomy makowej, który ma być przywieziony; jeżeli wniosek dotyczy preparatów, należy podać ponadto dawkę lub procentową zawartość czystego środka odurzającego lub substancji psychotropowej; jeżeli dotyczy opium, należy podać ponadto jego gatunek i zawartość morfiny,
4) wskazanie przejścia granicznego, przez które dokonany będzie wywóz,
5) nazwę i adres odbiorcy przesyłki oraz kraj jej przeznaczenia.
2. Do wniosku dołączyć należy oryginał zezwolenia przywozu wydanego przez właściwe władze kraju przywozu.
2. Certyfikat przywozu i certyfikat wywozu wystawiane są w języku polskim i w języku angielskim.
3. Wzór certyfikatu przywozu stanowi załącznik nr 3 do rozporządzenia, a wzór certyfikatu wywozu – załącznik nr 4 do rozporządzenia.
1) prowadzenia ewidencji przychodu i rozchodu środków odurzających, substancji psychotropowych, prekursorów grupy I-R lub słomy makowej,
2) przechowywania środków odurzających, substancji psychotropowych, prekursorów grupy I-R lub słomy makowej w odrębnych pomieszczeniach spełniających warunki określone w § 10 ust. 1 pkt 4,
3) wydawania środków odurzających, substancji psychotropowych, prekursorów grupy I-R lub słomy makowej jedynie na podstawie pisemnego zapotrzebowania według wzoru stanowiącego załącznik nr 1 do rozporządzenia i za pokwitowaniem odbioru.
2. Ewidencję rozchodu i przychodu, o której mowa w ust. 1 pkt 1, podmiot gospodarczy prowadzi na zasadach i w sposób określony w § 11 i 12.
1) numer i datę wydania koncesji na prowadzenie hurtowni farmaceutycznej,
2) nazwę i adres podmiotu gospodarczego,
3) wskazanie miejsca działalności określonej we wniosku – adres magazynu, w którym będą przechowywane środki odurzające, substancje psychotropowe i prekursory,
4) określenie grupy środków odurzających, substancji psychotropowych i prekursorów grupy I-R, których dotyczy wniosek,
5) sposób przechowywania i zabezpieczania środków odurzających, substancji psychotropowych i prekursorów grupy I-R przed ich kradzieżą bądź użyciem do celów niezgodnych z przeznaczeniem,
6) dane osoby (imię, nazwisko, wykształcenie, staż pracy) odpowiedzialnej za zapewnienie systemu kontroli i zabezpieczania tych środków i substancji w hurtowni,
7) datę sporządzenia wniosku i podpis osoby upoważnionej do reprezentowania podmiotu gospodarczego.
2. Dane, o których mowa w ust. 1 pkt 6, mogą być przetwarzane tylko zgodnie z przepisami ustawy z dnia 29 sierpnia 1997 r. o ochronie danych osobowych.
1) posiada system zabezpieczania pomieszczeń magazynowych przeznaczonych wyłącznie do przechowywania środków odurzających, substancji psychotropowych i prekursorów grupy I-R objętych zezwoleniem,
2) posiada system kontroli nad obrotem i ewidencją środków odurzających, substancji psychotropowych i prekursorów grupy I-R,
3) zatrudnia pracownika będącego farmaceutą co najmniej z 2-letnim stażem pracy zawodowej wykonującego obowiązki wymienione w § 7 ust. 1 pkt 2.
2. Na prowadzenie obrotu hurtowego środków odurzających, substancji psychotropowych lub prekursorów grupy I-R wpisanych do rejestru prowadzonego przez ministra właściwego do spraw rolnictwa minister właściwy do spraw zdrowia wydaje odrębne zezwolenie.
1) przechowywania środków odurzających, substancji psychotropowych i prekursorów grupy I-R zgodnie z § 10 ust. 1 pkt 4,
2) wydawania środków odurzających, substancji psychotropowych i prekursorów grupy I-R wyłącznie na podstawie pisemnego zapotrzebowania według wzoru określonego w załączniku nr 1 do rozporządzenia i za pisemnym pokwitowaniem odbioru,
3) prowadzenia ewidencji przychodu i rozchodu środków odurzających, substancji psychotropowych i prekursorów grupy I-R w sposób i na zasadach określonych w § 11 i 12.
2. Cofnięcie zezwolenia następuje po stwierdzeniu przez wojewódzkiego inspektora farmaceutycznego nieprzestrzegania przepisów ustawy oraz niedotrzymywania warunków określonych w zezwoleniu.
3. Cofnięcia zezwolenia dokonuje organ, który je wydał.
2. Zgłoszenie dotyczy również informacji o zakończeniu prowadzenia działalności, o której mowa w ust. 1.
3. Zgłoszenie o zaprzestaniu działalności powinno być dokonane w terminie nie krótszym niż 30 dni przed jej zakończeniem.
4. Zgłoszenie, o którym mowa w ust. 1 i 2, powinno zawierać:
1) nazwę i adres podmiotu gospodarczego,
2) wskazanie miejsca prowadzenia działalności,
3) określenie zakresu działalności z wyszczególnieniem nazw substancji czynnych będących przedmiotem obrotu,
4) sposób przechowywania i zabezpieczania przed kradzieżą lub zniszczeniem środków odurzających, substancji psychotropowych lub prekursorów.
1) zabezpieczenia prekursorów grupy I-R przed kradzieżą lub zniszczeniem,
2) zgłoszenia zaprzestania działalności w terminie nie krótszym niż 30 dni przed jej zakończeniem,
3) prowadzenia dokumentacji zawierającej:
a) wykaz wszystkich dostawców i odbiorców,
b) dowody zakupu i sprzedaży, zawierające zwłaszcza nazwę substancji, jej postać, ilość lub stężenie, wielkość opakowania, numer serii i termin ważności,
c) datę dostawy lub wydania oraz pieczątkę i podpis kierownika hurtowni lub innej, pisemnie przez niego upoważnionej, osoby kontrolującej przyjęcie lub sprzedaż środka lub materiału,
d) rejestry zwrotów,
e) dokumentację zniszczenia prekursorów nie odpowiadających wymaganiom jakościowym, z określeniem sposobu, miejsca i nadzoru nad ich zniszczeniem.
2. Recepta wystawiona dla chorego w zaawansowanej chorobie nowotworowej na środki odurzające zawierające sole morfiny może dotyczyć takiej ilości środka, która nie przekracza
40-krotnej jednorazowej dawki maksymalnej określonej w Farmakopei Polskiej, a w razie gdy dawka ta nie jest tam określona – w ilości nie przekraczającej 4,0 g soli morfiny.
3. Na wniosek wystawiającego receptę właściwy wojewódzki inspektor farmaceutyczny może wyrazić zgodę na przepisywanie na recepcie środka odurzającego grupy I-N lub substancji psychotropowej grupy II-P w ilości większej niż określono w ust. 1 i 2. Ilość ta nie powinna jednak przekroczyć zapotrzebowania pacjenta na dwutygodniową kurację. Dokument potwierdzający wyrażenie zgody stanowi załącznik nr 6 do rozporządzenia.
4. Wniosek o wyrażenie zgody, o której mowa w ust. 3, powinien zawierać:
1) nazwę i adres zakładu opieki zdrowotnej lub praktyki lekarskiej, ubiegających się o wyrażenie zgody,
2) imię, nazwisko, wiek i adres chorego,
3) nazwę, postać, dawkę środka odurzającego lub substancji psychotropowej,
4) ilość środka lub substancji, która będzie wypisywana na jednej recepcie,
5) dawkowanie,
6) imię, nazwisko i podpis lekarza, który będzie wystawiał recepty, oraz jego pieczątkę.
5. Zgoda, o której mowa w ust. 3, wydawana jest na czas określony, nie dłuższy jednak niż na 3 miesiące.
6. Zgoda, o której mowa w ust. 3, przedstawiana jest przy każdej realizacji recepty na środek odurzający grupy I-N lub substancję psychotropową grupy II-P w ilości większej niż określona w ust. 1 i 2.
7. Przepisy ust. 1–5 nie dotyczą recept wystawionych na preparaty zawierające środki odurzające grupy III-N oraz substancje psychotropowe grupy II-P.
8. Recepty na leki przeznaczone do stosowania u zwierząt dotyczące preparatów zawierających środki odurzające grupy I-N lub substancje psychotropowe grupy II-P mogą dotyczyć tylko takiej ilości środka lub substancji, która nie przekracza 5-krotnej jednorazowej zapisanej dawki.
2. Wpis w dokumentację, o której mowa w ust. 1, powinien obejmować:
1) liczbę kolejną wpisu,
2) imię i nazwisko pacjenta, jego wiek i adres, a w przypadku gdy recepta wystawiana jest dla chorego zwierzęcia – gatunek, płeć oraz rasę zwierzęcia, a także imię, nazwisko oraz adres jego właściciela,
3) rozpoznanie choroby,
4) nazwę i ilość zapisanego leku gotowego lub skład leku recepturowego,
5) datę wystawienia recepty.
3. Przepisy ust. 1 i 2 dotyczą także recept wystawionych na potrzeby własne lekarza oraz jego rodziny.
2. Opisu recepty nie wydaje się, jeżeli zamieszczono na niej adnotację „wydać bez opisu".
2. Wzór zapotrzebowania na preparaty zawierające środki odurzające lub substancje psychotropowe na potrzeby zakładu opieki zdrowotnej lub praktyki lekarskiej oraz na preparaty zawierające środki odurzające lub substancje psychotropowe wydawane na potrzeby zakładu leczniczego dla zwierząt lub innego podmiotu uprawnionego do jego posiadania stanowi załącznik nr 7 do rozporządzenia.
2. Apteka obowiązana jest w szczególności:
1) przechowywać środki odurzające grup I-N i II-N oraz substancje psychotropowe grupy II-P w odpowiednio zabezpieczonych pomieszczeniach, w zamkniętych metalowych szafach lub kasetach przymocowanych w sposób trwały do ścian lub podłóg pomieszczenia,
2) przechowywać substancje psychotropowe grup III-P i IV-P w zamkniętych na klucz szafach magazynowych lub ekspedycyjnych.
2. Prowadzenie ewidencji, o której mowa w ust. 1, należy do obowiązków kierownika apteki.
3. Kierownik apteki może upoważnić do prowadzenia ewidencji zatrudnionego w aptece aptekarza posiadającego prawo samodzielnego wykonywania zawodu.
4. Preparaty zawierające środki odurzające grupy II-N, substancje psychotropowe grup III-P
i IV-P, znajdujące się w urzędowym wykazie środków farmaceutycznych i materiałów medycznych dopuszczonych do obrotu w Polsce, wydanym na podstawie art. 18 ust. 2 ustawy z dnia 10 października 1991 r. o środkach farmaceutycznych, materiałach medycznych, aptekach, hurtowniach i Inspekcji Farmaceutycznej:
1) oznaczone symbolem „Rp" – mogą być wydawane na recepty bez specjalnego oznakowania,
2) nie zawierające oznaczenia symbolem „Rp" – mogą być wydawane bez recepty.
2. Zapas preparatów zawierających środki odurzające grup I-N i II-N oraz substancje psychotropowe grup II-P, III-P i IV-P, które mogą posiadać podmioty, nie może przekraczać:
1) dla zakładów opieki zdrowotnej i zakładów leczniczych dla zwierząt – średniego 14-dniowego zużycia przez ten zakład,
2) dla lekarzy, lekarzy stomatologów lub lekarzy weterynarii – średniego 7-dniowego zużycia przez tych lekarzy,
3) dla statków morskich i powietrznych – standardów ustalonych przez Światową Organizację Zdrowia,
4) dla magazynów zapasów wojennych jednostek wojskowych, okrętów wojennych i wojskowych, składnic sanitarnych – norm przewidzianych odrębnymi przepisami.
2. Środki farmaceutyczne, o których mowa w ust. 1, przechowywać należy w wydzielonych pomieszczeniach w zamkniętych metalowych kasetach przytwierdzonych na stałe do podłoża i umieszczonych w miejscach niewidocznych.
2. Dokumentację posiadania i stosowania środków, o których mowa w ust. 1, w formie książki kontroli, podmiot prowadzi na zasadach i w sposób określony w § 11 i 12, z tym że zatwierdzenia książki przed jej prowadzeniem dokonuje kierownik podmiotu prowadzącego dokumentację, a w odniesieniu do statku – kapitan.
2. Osobą, o której mowa w ust. 1, jest:
1) w zakładzie opieki zdrowotnej – farmaceuta lub lekarz,
2) w pracowni analiz – osoba, o której mowa w pkt 1, oraz osoba z innym medycznym wyższym wykształceniem,
3) w zakładzie leczniczym dla zwierząt – lekarz weterynarii lub farmaceuta,
4) na statku – lekarz, kapitan statku lub oficer przez niego upoważniony,
5) w zakładach opieki zdrowotnej będących stacją pogotowia ratunkowego lub w zakładach opiekuńczo-leczniczych i pielęgnacyjno-opiekuńczych: lekarz, lekarz stomatolog, farmaceuta lub pielęgniarka z wyższym wykształceniem pielęgniarskim.
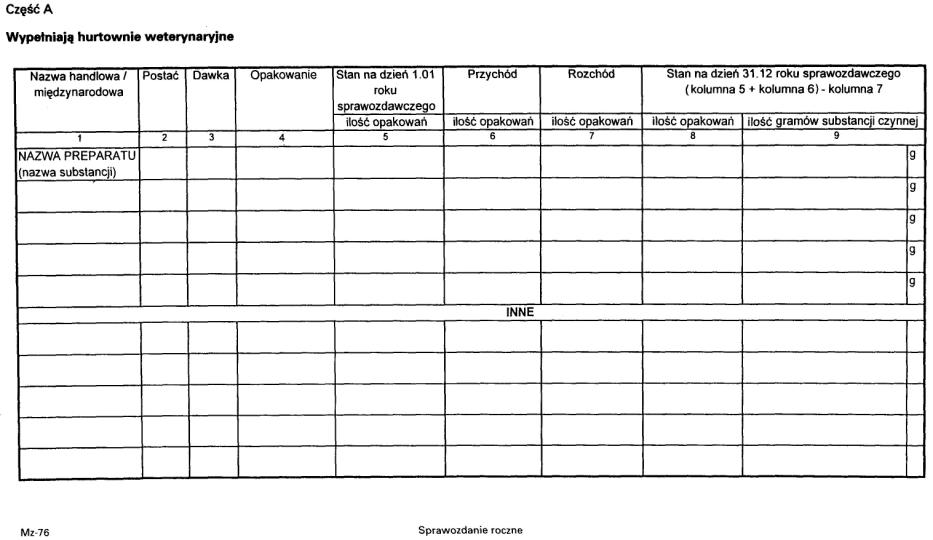
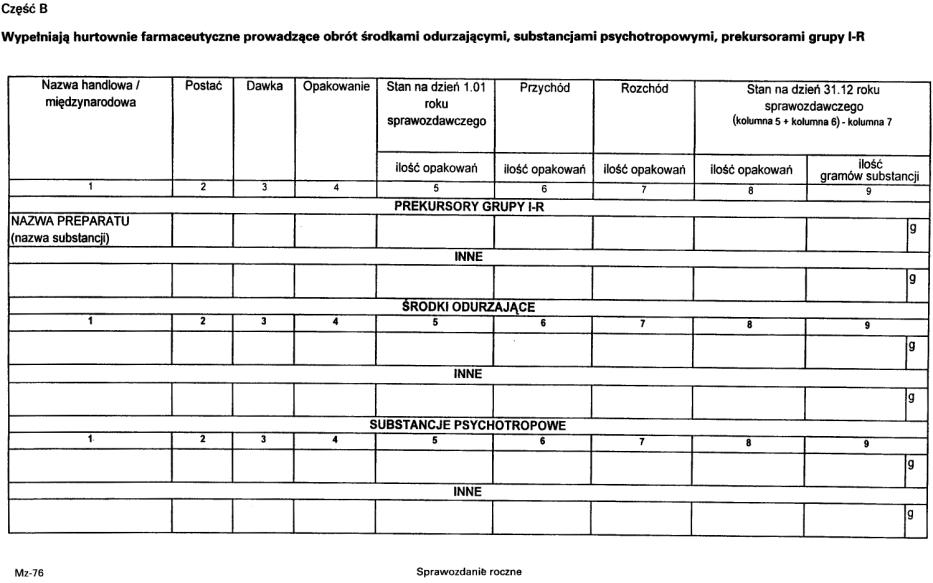
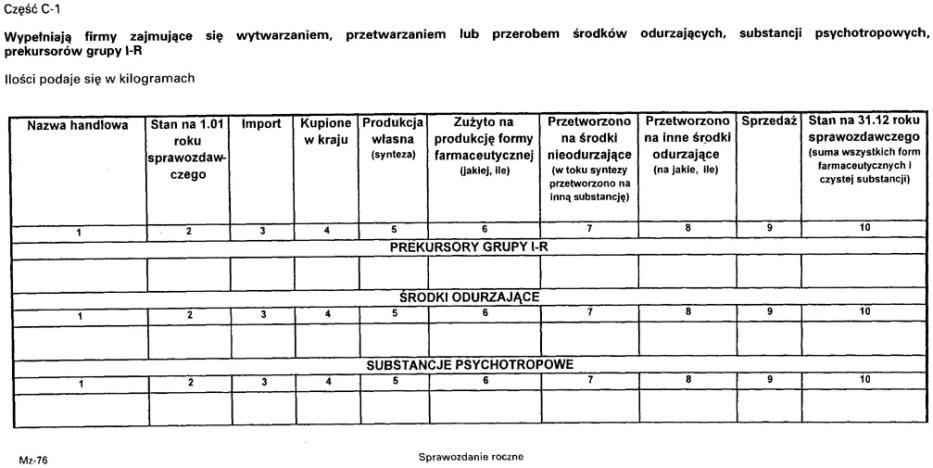
2. Sprawozdanie składane jest według wzoru stanowiącego załącznik nr 8 do rozporządzenia.
3. Sprawozdanie podpisuje kierownik oraz osoba odpowiedzialna za nadzór nad środkami odurzającymi, substancjami psychotropowymi i prekursorami grupy I-R.
Minister Zdrowia: w z. M. Piróg
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 3 sierpnia 2000 r. (poz. 885)
Załącznik nr 1

Załącznik nr 2
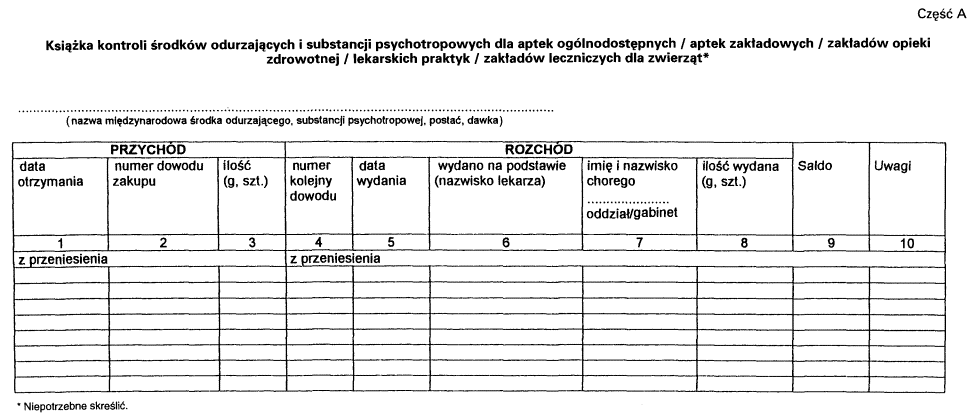
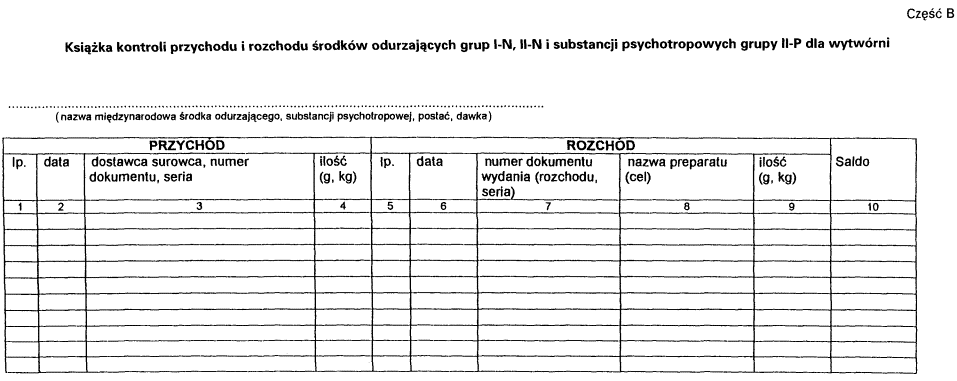

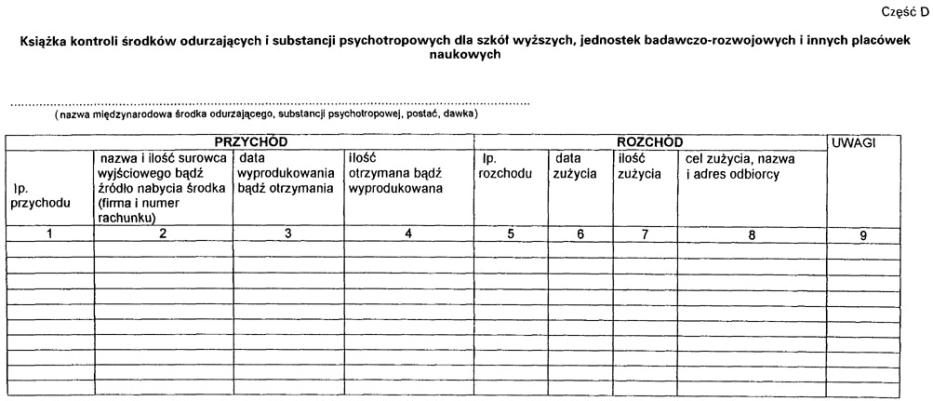
Załącznik nr 3

Załącznik nr 4

Załącznik nr 5
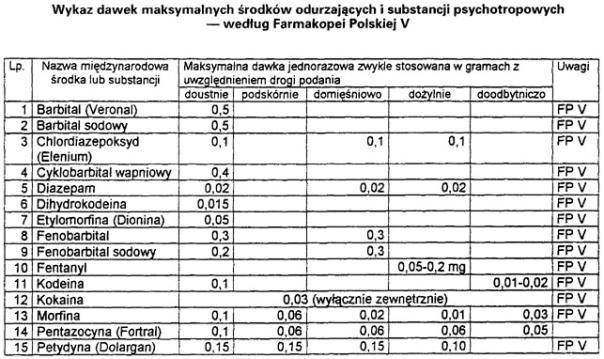
Załącznik nr 6

Załącznik nr 7

Załącznik nr 8


- Data ogłoszenia: 2000-09-20
- Data wejścia w życie: 2000-10-05
- Data obowiązywania: 2000-10-05
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
