REKLAMA
Dziennik Ustaw - rok 2002 nr 69 poz. 643
ROZPORZĄDZENIE MINISTRA ZDROWIA
z dnia 17 maja 2002 r.
w sprawie zakresu informacji i wniosków niezbędnych do ustalenia cen urzędowych na środki farmaceutyczne i materiały medyczne, sposobu i terminów przedkładania informacji oraz trybu i terminów rozpatrywania wniosków i informacji.
Na podstawie art. 6 ust. 2 ustawy z dnia 5 lipca 2001 r. o cenach (Dz. U. Nr 97, poz. 1050) zarządza się, co następuje:
1) zakres informacji i wniosków, niezbędnych do ustalenia cen urzędowych na środki farmaceutyczne i materiały medyczne, objęte wykazami, o których mowa w art. 5 ust. 1 i 3 ustawy z dnia 5 lipca 2001 r. o cenach, zwanej dalej „ustawą”,
2) sposób i terminy przedkładania informacji oraz tryb i terminy rozpatrywania informacji i wniosków, o których mowa w pkt 1.
1) nazwę i adres przedsiębiorcy, wraz z aktualnym odpisem z rejestru, do którego przedsiębiorca jest wpisany, lub równoważnym mu dokumentem wystawionym poza granicami Rzeczypospolitej Polskiej, wydanym w terminie nie później niż trzy miesiące przed dniem złożenia wniosku; w przypadku przedsiębiorców zagranicznych należy dodatkowo dołączyć tłumaczenie odpisu na język polski dokonane przez tłumacza przysięgłego,
2) dane dotyczące środka farmaceutycznego lub materiału medycznego,
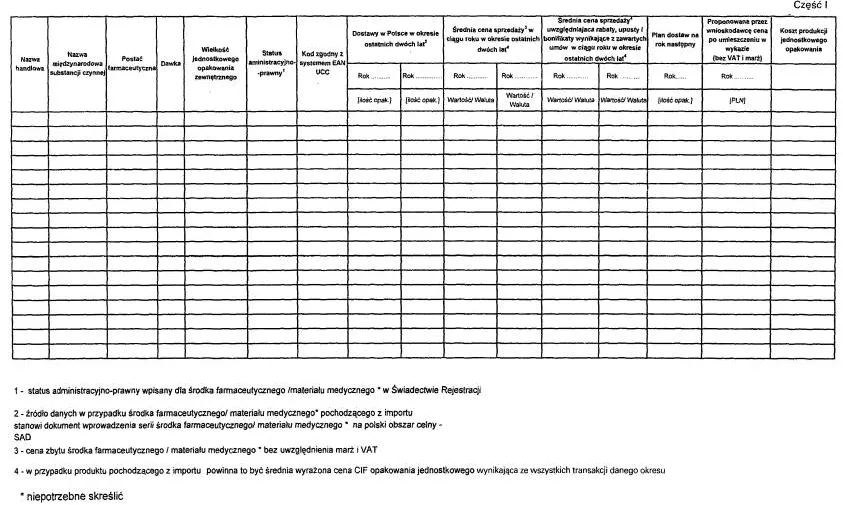
3) informacje dotyczące wielkości dostaw, sprzedaży i cen (w tym ceny z uwzględnieniem rabatów, upustów i bonifikat wynikających z zawartych umów),
4) proponowaną cenę wraz z kalkulacją i uzasadnieniem,
5) podpis osoby lub osób upoważnionych do reprezentowania przedsiębiorcy.
2. Zakres informacji, o których mowa w ust. 1:
1) w pkt 1, 2, 4 – określa załącznik nr 1 do rozporządzenia,
2) w pkt 3 – określa załącznik nr 2 do rozporządzenia.
1) załącznik nr 1 –plik txt,
2) załącznik nr 2 – plik Excel.
2. W przypadku przedłożenia informacji lub wniosku niezawierającego wymaganych informacji, minister właściwy do spraw zdrowia wyznacza wnioskodawcy termin do uzupełnienia informacji niezbędnych do rozpatrzenia informacji lub wniosku. Termin do rozpatrzenia wniosku lub informacji liczy się od dnia otrzymania uzupełnienia.
3. Nieuzupełnienie informacji lub wniosku w wyznaczonym terminie powoduje pozostawienie sprawy bez rozpatrzenia.
4. Informacja lub wniosek odpowiadający wymaganiom określonym w rozporządzeniu przekazywany jest niezwłocznie Zespołowi do Spraw Gospodarki Lekami w celu jego rozpatrzenia.
1) 90 dni – w przypadku rozpatrywania informacji i wniosków niezbędnych do ustalenia cen urzędowych,
2) 30 dni – w przypadku wniosków o obniżenie cen urzędowych.
2. Termin, o którym mowa w ust. 1 pkt 1, może zostać przedłużony o 90 dni w przypadku, gdy informacje i wnioski niezbędne do ustalenia ceny urzędowej na środki farmaceutyczne lub materiały medyczne są rozpatrywane łącznie z wnioskami o umieszczenie danego środka farmaceutycznego lub materiału medycznego we właściwym wykazie, o którym mowa w art. 5 ust. 1 ustawy.
Minister Zdrowia: M. Łapiński
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 17 maja 2002 r. (poz. 643)
Załącznik nr 1
ZAKRES INFORMACJI/WNIOSKU* NIEZBĘDNYCH DO USTALENIA CEN URZĘDOWYCH ŚRODKÓW FARMACEUTYCZNYCH/MATERIAŁÓW MEDYCZNYCH*
| l. Informacje dotyczące środka farmaceutycznego/ materiału medycznego* |
| 1. Nazwa handlowa |
| 2. Nazwa międzynarodowa substancji czynnej (-ych) |
| 3. Postać farmaceutyczna, dawka |
| 4. Oznaczenie przedsiębiorcy ze wskazaniem siedziby i adresu |
| 5. Wielkość jednostkowego opakowania (-ń) zewnętrznego (-ych) oraz kod (-y) zgodny (-e) z systemem EAN UCC |
| 6. Numer świadectwa Rejestracji potwierdzającego wpis do Rejestru Środków Farmaceutycznych i Materiałów Medycznych prowadzonego przez ministra właściwego do spraw zdrowia |
| ze wskazaniem: |
| 2) daty przedłużenia ważności wpisu oraz numeru Świadectwa Rejestracji |
| 7. Kod i opis grupy terapeutycznej ATC (do 4 poziomu) ustalonej przez Światową |
|
|
* Niepotrzebne skreślić.
| 8. Wielkość DDD (określona dawka w zależności od wskazania) określona przez Światową Organizację Zdrowia (WHO) |
| 9. Czas standardowej kuracji |
| 10. Dzienny koszt terapii oraz średni koszt standardowej terapii |
| II. Informacje o środku farmaceutycznym/ |
| 1. Data pierwszej rejestracji. Data ważności Świadectwa Rejestracji |
| 2. Cena zbytu (cena wytwórcy, bez VAT i marż) |
| III. Informacje o środku farmaceutycznym / |
| 1. Rejestracje w innych krajach (kraj, data rejestracji, ewentualnie data skreślenia z rejestru), ze szczególnym wskazaniem stanu rejestracji w poszczególnych krajach Unii Europejskiej |
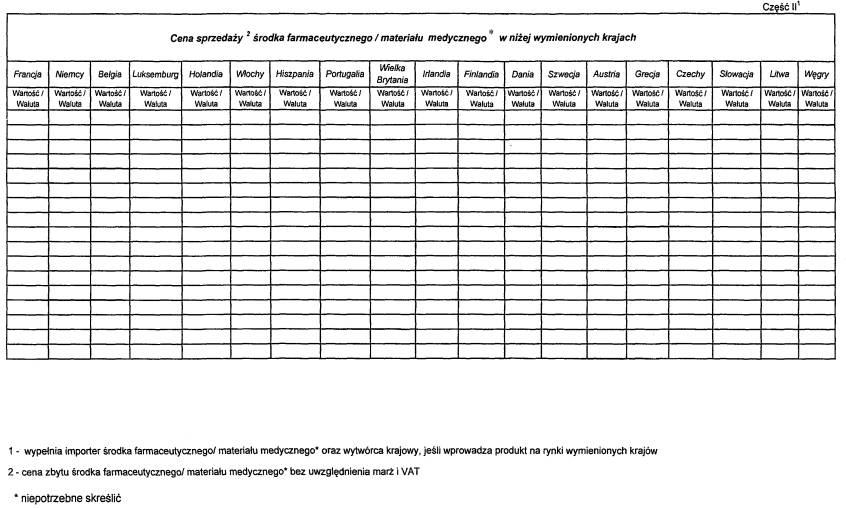
| 2. Kraje, w których środek farmaceutyczny/ materiał medyczny* jest refundowany (procent refundacji) |
|
|
* Niepotrzebne skreślić.
| IV. Dodatkowe informacje na temat |
| 1. Proponowana cena (bez VAT, bez marż) w PLN, po umieszczeniu w wykazie leków podstawowych i uzupełniających lub wykazie leków i materiałów medycznych, które mogą być przepisywane bezpłatnie, za opłatą ryczałtową lub częściową odpłatnością osobom chorującym na choroby zakaźne lub psychiczne oraz upośledzonym umysłowo, a także chorującym na niektóre choroby przewlekłe, wrodzone, nabyte, wraz z kalkulacją. |
| 2. Struktura i wielkość sprzedaży w Polsce (w zależności od wskazania terapeutycznego jeśli dotyczy) |
| V. Bezpieczeństwo stosowania |
| 1. Czy zgłoszono w Polsce zaobserwowane (jakie?) niepożądane działania środka farmaceutycznego/ materiału medycznego* w okresie ostatnich 5 lat? |
| 2. Jakie niepożądane działania środka farmaceutycznego/ materiału medycznego* zgłoszono w kraju wnioskodawcy i w innych krajach w okresie ostatnich 5 lat? |
|
|
* Niepotrzebne skreślić.

Załącznik nr 2
INFORMACJA NA TEMAT WIELKOŚCI DOSTAW, SPRZEDAŻY I CEN ŚRODKA FARMACEUTYCZNEGO/MATERIAŁU MEDYCZNEGO*, KTÓREGO DOTYCZY INFORMACJA LUB WNIOSEK
- Data ogłoszenia: 2002-06-07
- Data wejścia w życie: 2002-06-15
- Data obowiązywania: 2002-06-15
- Dokument traci ważność: 2012-01-01
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
