REKLAMA
Dziennik Ustaw - rok 2006 nr 167 poz. 1190
ROZPORZĄDZENIE MINISTRA ZDROWIA1)
z dnia 6 września 2006 r.
w sprawie sposobu i trybu dokonywania zmian danych objętych pozwoleniem, pozwoleniem tymczasowym albo wpisem do rejestru oraz zmian dokumentacji będącej podstawą wydania pozwolenia, pozwolenia tymczasowego albo wpisu do rejestru
Na podstawie art. 19a ust. 2 ustawy z dnia 13 września 2002 r. o produktach biobójczych (Dz. U. Nr 175, poz. 1433, z późn. zm.2)) zarządza się, co następuje:
1) wzór wniosku o dokonanie zmian danych w pozwoleniu, pozwoleniu tymczasowym albo wpisie do rejestru oraz zmian dokumentacji będącej podstawą wydania pozwolenia, pozwolenia tymczasowego albo wpisu do rejestru;
2) rodzaj i zakres dokonywanych zmian, o których mowa w pkt 1, oraz zakres wymaganych dokumentów i badań uzasadniających wprowadzenie zmiany;
3) rodzaj zmian, o których mowa w pkt 1, wymagających złożenia wniosku o wydanie pozwolenia, pozwolenia tymczasowego albo wpisu do rejestru;
4) sposób i tryb dokonywania zmian, o których mowa w pkt 1.
1) dotyczące substancji czynnej, polegające na:
a) dodaniu jednej lub kilku substancji czynnych,
b) usunięciu jednej lub kilku substancji czynnych,
c) zmianie ilości substancji czynnej,
d) zastąpieniu substancji czynnej inną solą/estrem, kompleksem/pochodną (ta sama część aktywna cząsteczki).
e) zastąpieniu substancji czynnej innym izomerem, inną mieszaniną izomerów, mieszaniny izolowanym izomerem;
2) dotyczące produktu biobójczego, polegające na:
a) dodaniu jednej lub kilku substancji potencjalnie niebezpiecznej lub substancji bazowej,
b) usunięciu jednej lub kilku substancji potencjalnie niebezpiecznej lub substancji bazowej,
c) zmianie zawartości substancji potencjalnie niebezpiecznej,
d) zmianie zawartości substancji bazowej,
e) rozszerzeniu grupy organizmów będących przedmiotem zwalczania.
2. W przypadku zmian, o których mowa w ust. 1, do wniosku dołącza się dokumentację zgodną z przepisami o dokumentacji niezbędnej do oceny substancji czynnej i produktu biobójczego.
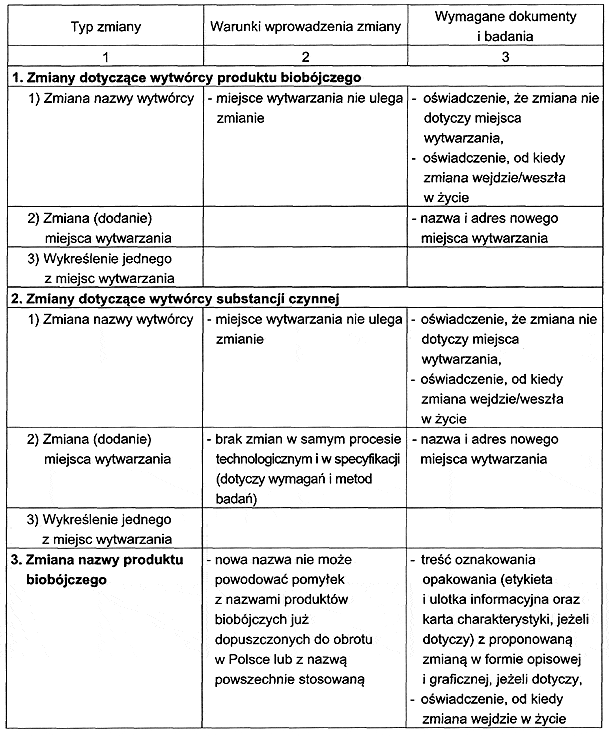
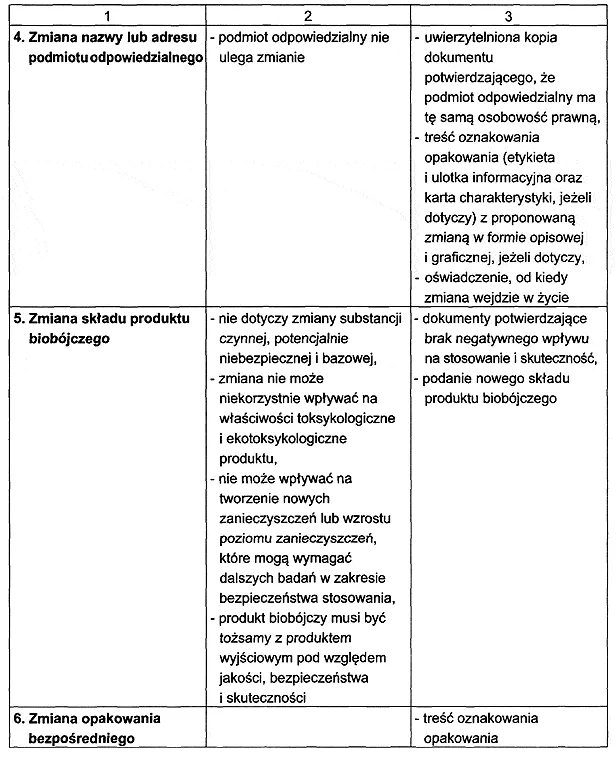
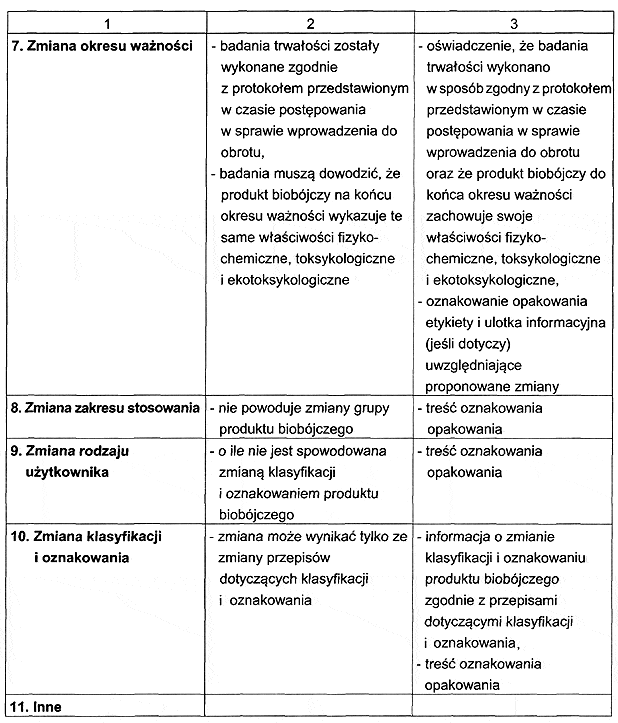
2. W zależności od dokonywanej zmiany do wniosku o dokonanie zmian, o których mowa w § 1 pkt 1, podmiot odpowiedzialny dołącza dokumenty i badania określone w załączniku nr 2 do rozporządzenia.
3. Zmian, o których mowa w § 1 pkt 1, dotyczących:
1) pozwolenia albo pozwolenia tymczasowego oraz dokumentacji będącej podstawą ich wydania – dokonuje się w terminie 90 dni od dnia złożenia wniosku, a w uzasadnionych przypadkach – 120 dni;
2) wpisu do rejestru oraz dokumentacji będącej podstawą jego wydania – dokonuje się w terminie 30 dni od dnia złożenia wniosku, a w uzasadnionych przypadkach – 60 dni.
Minister Zdrowia: Z. Religa
|
|
1) Minister Zdrowia kieruje działem administracji rządowej – zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 18 lipca 2006 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. Nr 131, poz. 924).
2) Zmiany wymienionej ustawy zostały ogłoszone w Dz. U. z 2003 r. Nr 189, poz. 1852, z 2004 r. Nr 173, poz. 1808, z 2005 r. Nr 180, poz. 1491 oraz z 2006 r. Nr 133, poz. 935.
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 6 września 2006 r. (poz. 1190)
Załącznik nr 1


Załącznik nr 2
RODZAJ I ZAKRES DOKONYWANYCH ZMIAN DANYCH W POZWOLENIU, POZWOLENIU TYMCZASOWYM ALBO WPISIE DO REJESTRU ORAZ ZMIAN DOKUMENTACJI BĘDĄCEJ PODSTAWĄ WYDANIA POZWOLENIA, POZWOLENIA TYMCZASOWEGO ALBO WPISU DO REJESTRU ORAZ ZAKRES WYMAGANYCH DOKUMENTÓW I BADAŃ UZASADNIAJĄCYCH WPROWADZENIE ZMIANY
- Data ogłoszenia: 2006-09-19
- Data wejścia w życie: 2006-10-04
- Data obowiązywania: 2006-10-04
- Dokument traci ważność: 2015-12-05
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
