REKLAMA
Dziennik Ustaw - rok 2018 poz. 2008
ROZPORZĄDZENIE
MINISTRA ZDROWIA1)
z dnia 12 października 2018 r.
w sprawie zapotrzebowań oraz wydawania z apteki produktów leczniczych, środków spożywczych specjalnego przeznaczenia żywieniowego i wyrobów medycznych
Na podstawie art. 96 ust. 9 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (Dz. U. z 2017 r. poz. 2211, z późn. zm.2)) zarządza się, co następuje:
§ 1. [Zakres regulacji]
1) sposób realizacji zapotrzebowania podmiotu wykonującego działalność leczniczą, zwanego dalej „zapotrzebowaniem”;
2) sposób sporządzania leku recepturowego i aptecznego;
3) sposób wydawania z apteki produktów leczniczych, środków spożywczych specjalnego przeznaczenia żywieniowego lub wyrobów medycznych;
4) wzór zapotrzebowania;
5) sposób prowadzenia oraz wzory ewidencji zapotrzebowań, ewidencji recept farmaceutycznych i ewidencji zrealizowanych zapotrzebowań.
§ 2. [Realizacja zapotrzebowania]
1) sprawdzenie prawidłowości wystawienia zapotrzebowania, w tym jego zgodności z wzorem określonym w załączniku nr 1 do rozporządzenia, a w przypadku środków odurzających i substancji psychotropowych będących produktami leczniczymi – zgodności z wzorem określonym w przepisach wydanych na podstawie art. 41 ust. 5 ustawy z dnia 29 lipca 2005 r. o przeciwdziałaniu narkomanii (Dz. U. z 2018 r. poz. 1030, 1490 i 1669);
2) sprawdzenie w rejestrze podmiotów wykonujących działalność leczniczą, o którym mowa w art. 100 ust. 1 ustawy z dnia 15 kwietnia 2011 r. o działalności leczniczej (Dz. U. z 2018 r. poz. 160, z późn. zm.3)), czy zapotrzebowanie wystawił podmiot wykonujący działalność leczniczą;
3) ocenę autentyczności zapotrzebowania;
4) sprawdzenie terminu ważności zapotrzebowania;
5) potwierdzenie na dokumencie zapotrzebowania albo na odrębnym dokumencie przechowywanym łącznie z tym zapotrzebowaniem wydania produktów leczniczych, środków spożywczych specjalnego przeznaczenia żywieniowego lub wyrobów medycznych obejmujące:
a) podanie daty realizacji zapotrzebowania,
b) określenie ilości, numerów serii i dat ważności wydanych produktów leczniczych, środków spożywczych specjalnego przeznaczenia żywieniowego lub wyrobów medycznych,
c) złożenie podpisu oraz naniesienie w formie nadruku albo pieczątki imienia i nazwiska wydającego;
6) wydanie z apteki produktu leczniczego, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego zgodnie z § 5.
2. Produkt leczniczy, środek spożywczy specjalnego przeznaczenia żywieniowego lub wyrób medyczny może być wydany na podstawie zapotrzebowania wyłącznie osobie upoważnionej na piśmie przez kierownika podmiotu leczniczego, w którym zostało wystawione zapotrzebowanie.
§ 3. [Lek apteczny]
§ 4. [Lek recepturowy]
2. Osoba sporządzająca lek recepturowy:
1) stosuje surowiec farmaceutyczny dopuszczony do obrotu na zasadach określonych w ustawie z dnia 6 września 2001 r. – Prawo farmaceutyczne;
2) stosuje surowiec farmaceutyczny o stężeniu pozwalającym na uzyskanie przepisanej ilości substancji czynnej w wydawanym produkcie leczniczym, pod warunkiem że nie wpłynie to na bezpieczeństwo lub skuteczność stosowania produktu leczniczego;
3) dokonuje korekty składu leku recepturowego, jeżeli podany na recepcie skład może tworzyć niezgodność chemiczną lub fizyczną, mogącą zmienić działanie leku lub jego wygląd, przez:
a) dodanie surowca farmaceutycznego ułatwiającego prawidłowe przygotowanie postaci leku lub pozwalającego na uzyskanie jednolitego dawkowania,
b) prawidłowy dobór surowców farmaceutycznych, zapewniający rozpuszczenie wszystkich składników leku w celu uzyskania jego właściwej postaci,
c) zmianę postaci surowca farmaceutycznego z rozpuszczalnej na nierozpuszczalną lub odwrotnie, z uwzględnieniem koniecznej różnicy w ilości surowca;
4) zmniejsza ilość surowca farmaceutycznego w składzie leku recepturowego do wielkości określonej przez dawkę maksymalną, jeżeli dawka maksymalna jest dla tego surowca ustalona oraz ze składu oraz sposobu użycia podanego w recepcie wynika, że nastąpiło przekroczenie dawki maksymalnej, a wystawiający receptę nie uczynił adnotacji o konieczności zastosowania dawki wskazanej w składzie leku;
5) może dokonywać zmiany składników obojętnych farmakologicznie.
3. Zmiany lub korekty składu leku recepturowego, o których mowa w ust. 2 pkt 3–5, odnotowuje się w Dokumencie Realizacji Recepty, o którym mowa w przepisach wydanych na podstawie art. 96a ust. 12 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, a w przypadku braku dostępu do systemu teleinformatycznego, o którym mowa w art. 7 ustawy z dnia 28 kwietnia 2011 r. o systemie informacji w ochronie zdrowia (Dz. U. z 2017 r. poz. 1845 oraz z 2018 r. poz. 697, 1515 i 1544) – na recepcie w postaci papierowej, odrębnym dokumencie przechowywanym łącznie z tą receptą lub na wydruku, o którym mowa w art. 96b ust. 2 pkt 3 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne.
§ 5. [Obowiązki osoby wydającej z apteki produkt leczniczy, środek spożywczy specjalnego przeznaczenia żywieniowego lub wyrób medyczny]
1) sprawdza termin ważności produktu leczniczego, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego oraz, jeżeli jest to możliwe, kontroluje wizualnie, czy produkt leczniczy, środek spożywczy specjalnego przeznaczenia żywieniowego lub wyrób medyczny nie wykazuje cech świadczących o jego sfałszowaniu lub niewłaściwej jakości;
2) w przypadku uzasadnionego podejrzenia ocenia, czy produkt leczniczy, środek spożywczy specjalnego przeznaczenia żywieniowego lub wyrób medyczny nie zostaną zastosowane w celu pozamedycznym;
3) ocenia autentyczność recepty;
4) jest uprawniona do żądania okazania dokumentu stwierdzającego wiek osoby, jeżeli wydanie produktu leczniczego, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego jest ograniczone wiekiem;
5) udziela informacji dotyczących przechowywania i stosowania wydawanego produktu leczniczego, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego, o ile są one dostępne;
6) udziela informacji o środkach ostrożności związanych z przyjmowaniem wydawanego produktu leczniczego, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego, o ile są one dostępne;
7) wydaje paragon fiskalny lub fakturę.
2. Farmaceuta wydający z apteki produkt leczniczy, środek spożywczy specjalnego przeznaczenia żywieniowego lub wyrób medyczny w razie potrzeby analizuje działanie farmakologiczne produktów leczniczych, środków spożywczych specjalnego przeznaczenia żywieniowego lub wyrobów medycznych pod kątem ich ewentualnych interakcji i informuje o nich odbierającego.
3. Dopuszcza się dzielenie opakowań następujących produktów leczniczych:
1) antybiotyki do stosowania wewnętrznego,
2) w postaci przeznaczonej do podawania pozajelitowego,
3) w postaci do podawania wziewnego,
4) posiadających kategorię dostępności „Rpw”,
5) zawierających substancje psychotropowe z grup III–P i IV–P lub środki odurzające z grupy II–N, określone w ustawie z dnia 29 lipca 2005 r. o przeciwdziałaniu narkomanii
– jeżeli nie przyczyni się to do zmiany gwarantowanej przez producenta jakości produktu leczniczego, a każde wydane opakowanie bezpośrednie jest oznakowane datą ważności i numerem serii, w opakowaniu własnym apteki, do którego dołącza się ulotkę lub jej kopię.
4. Osoba wydająca produkt leczniczy dzieli zawartość opakowania do ilości maksymalnie zbliżonej, ale nie większej niż jest określona na recepcie.
5. Dzieleniu, o którym mowa w ust. 3, nie podlega opakowanie bezpośrednie.
6. Jeżeli określona na zapotrzebowaniu lub recepcie ilość produktu leczniczego, środka spożywczego specjalnego przeznaczenia żywieniowego lub wyrobu medycznego jest mniejsza niż ilość znajdująca się w najmniejszym dopuszczonym do obrotu opakowaniu bezpośrednim, wydaje się jedno takie opakowanie.
7. Dopuszcza się wydanie z apteki produktu leczniczego o:
1) mocy niższej niż określona na recepcie, jeżeli całkowita ilość substancji czynnej zawartej w wydawanym produkcie leczniczym odpowiada całkowitej ilości substancji czynnej zawartej w produkcie leczniczym zapisanym na recepcie;
2) postaci innej niż określona na recepcie, pod warunkiem że nie wpłynie to na bezpieczeństwo lub skuteczność stosowania produktu leczniczego.
8. Wydanie produktu leczniczego w sposób określony w ust. 7 jest możliwe jedynie po uzyskaniu zgody osoby odbierającej produkt leczniczy.
9. Osoba wydająca, wydając produkt leczniczy w sposób określony w ust. 7, informuje osobę odbierającą produkt leczniczy, w formie pisemnej, o zmienionym sposobie dawkowania.
10. Zmiany, o których mowa w ust. 7, odnotowuje się w Dokumencie Realizacji Recepty, o którym mowa w przepisach wydanych na podstawie art. 96a ust. 12 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne, a w przypadku braku dostępu do systemu teleinformatycznego, o którym mowa w art. 7 ustawy z dnia 28 kwietnia 2011 r. o systemie informacji w ochronie zdrowia – na recepcie w postaci papierowej, odrębnym dokumencie przechowywanym łącznie z tą receptą lub na wydruku, o którym mowa w art. 96b ust. 2 pkt 3 ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne.
11. Leku recepturowego zawierającego w swoim składzie surowiec farmaceutyczny będący środkiem bardzo silnie działającym, środkiem odurzającym, substancją psychotropową lub prekursorem kategorii 1 nie wydaje się na podstawie odpisu recepty.
12. Dopuszcza się wydanie leku recepturowego zawierającego w swoim składzie surowiec farmaceutyczny będący substancją silnie działającą, na podstawie odpisu recepty, jeżeli jego dawka dzienna lub jednorazowa nie przekracza maksymalnej dawki dziennej lub jednorazowej określonej w Farmakopei Polskiej, Farmakopei Europejskiej lub innych farmakopeach uznawanych w państwach członkowskich Unii Europejskiej.
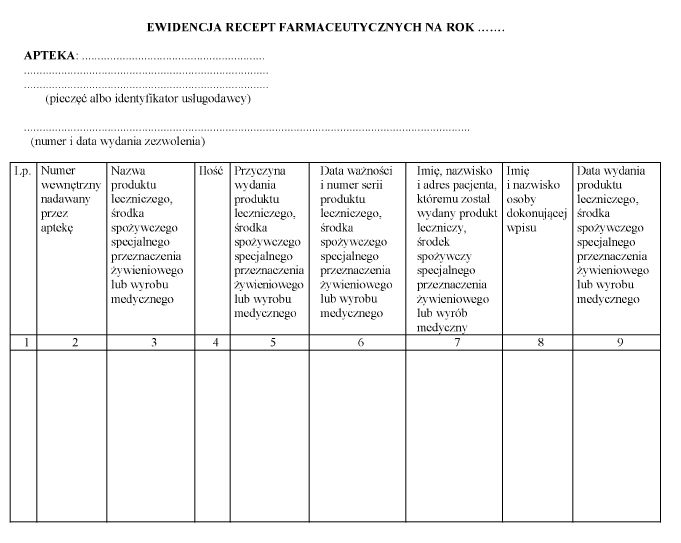
§ 6. [Ewidencja recept farmaceutycznych]
2. Wzór ewidencji recept farmaceutycznych jest określony w załączniku nr 2 do rozporządzenia.
3. Ewidencja zapotrzebowań jest prowadzona na bieżąco w postaci elektronicznej albo papierowej, w sposób umożliwiający identyfikację osób dokonujących w niej wpisów, pozwalający na określenie liczby wystawionych zapotrzebowań oraz liczby pacjentów, dla których zamówiono – w związku z planowanym udzieleniem świadczenia zdrowotnego – produkty lecznicze, środki spożywcze specjalnego przeznaczenia żywieniowego lub wyroby medyczne, w okresie roku kalendarzowego.
4. Wzór ewidencji zapotrzebowań jest określony w załączniku nr 3 do rozporządzenia.
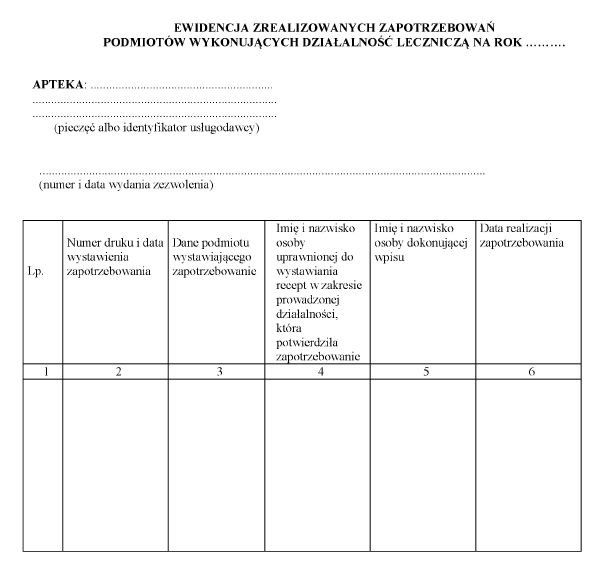
5. Ewidencja zrealizowanych zapotrzebowań jest prowadzona na bieżąco w postaci elektronicznej albo papierowej, w sposób umożliwiający identyfikację osób dokonujących w niej wpisów, pozwalający na określenie liczby zrealizowanych zapotrzebowań w okresie roku kalendarzowego.
6. Wzór ewidencji zrealizowanych zapotrzebowań jest określony w załączniku nr 4 do rozporządzenia.
§ 7. [Przepis przejściowy]
2. Apteki dostosują sposób prowadzenia ewidencji recept farmaceutycznych do wymogów określonych w niniejszym rozporządzeniu w terminie do dnia 31 grudnia 2018 r.
3. Apteki mogą prowadzić ewidencję recept farmaceutycznych zgodnie z przepisami niniejszego rozporządzenia od pierwszego dnia miesiąca następującego po miesiącu jego wejścia w życie.
4. Zapotrzebowania sporządzone przed dniem wejścia w życie niniejszego rozporządzenia mogą być realizowane.
§ 8. [Wejście w życie]
Minister Zdrowia: wz. J. Szczurek-Żelazko
1) Minister Zdrowia kieruje działem administracji rządowej - zdrowie, na podstawie § 1 ust. 2 rozporządzenia Prezesa Rady Ministrów z dnia 10 stycznia 2018 r. w sprawie szczegółowego zakresu działania Ministra Zdrowia (Dz. U. poz. 95).
2) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2018 r. poz. 650, 697, 1039, 1375, 1515, 1544, 1629, 1637 i 1669.
3) Zmiany tekstu jednolitego wymienionej ustawy zostały ogłoszone w Dz. U. z 2018 r. poz. 138, 650, 1128, 1375, 1532, 1629, 1669 i 1693.
4) Niniejsze rozporządzenie było poprzedzone rozporządzeniem Ministra Zdrowia z dnia 18 października 2002 r. w sprawie wydawania z apteki produktów leczniczych i wyrobów medycznych (Dz. U. z 2016 r. poz. 493), które utraciło moc z dniem 18 kwietnia 2018 r. w związku z wejściem w życie ustawy z dnia 1 marca 2018 r. o zmianie niektórych ustaw w związku z wprowadzeniem e-recepty (Dz. U. poz. 697).
Załączniki do rozporządzenia Ministra Zdrowia
z dnia 12 października 2018 r. (poz. 2008)
Załącznik nr 1
WZÓR - ZAPOTRZEBOWANIE PODMIOTU WYKONUJĄCEGO DZIAŁALNOŚĆ LECZNICZĄ

Załącznik nr 2
WZÓR - EWIDENCJA RECEPT FARMACEUTYCZNYCH
Załącznik nr 3
WZÓR - EWIDENCJA ZAPOTRZEBOWAŃ PODMIOTÓW WYKONUJĄCYCH DZIAŁALNOŚĆ LECZNICZĄ

Załącznik nr 4
WZÓR - EWIDENCJA ZREALIZOWANYCH ZAPOTRZEBOWAŃ PODMIOTÓW WYKONUJĄCYCH DZIAŁALNOŚĆ LECZNICZĄ
- Data ogłoszenia: 2018-10-19
- Data wejścia w życie: 2018-10-20
- Data obowiązywania: 2019-11-15
- Dokument traci ważność: 2022-05-31
REKLAMA
Dziennik Ustaw
REKLAMA
REKLAMA
